Estudo de modelagem molecular de neolignanas encontradas em folhas de Virola surinamensis (Rol.) Warb, para avaliação da inibição da enzima cruzaína.
ISBN 978-85-85905-23-1
Área
Físico-Química
Autores
Souza Paes, S. (UFPA) ; Lima da Costa, A.P. (UFPA) ; Molfetta, F.A. (UFPA) ; Souza Viana, J. (UFPA) ; da Silva Santos, L. (UFPA) ; Pereira Xavier, L. (UFPA)
Resumo
Virola surinamensis (Rol.) Warb. é uma árvore de grande porte pertencente à família Myristicaceae, sendo conhecida popularmente como ucuúba, ucuúba-branca, ucuúba-cheirosa, entre outras. As substâncias inseridas na classe das neolignanas, isoladas desse gênero são responsáveis por um vasto conjunto de atividades biológicas, sendo uma delas contra o Trypanossoma cruzi (T. cruzi), agente parasitário causador da doença de Chagas. Neste trabalho foram realizados estudos de docagem molecular, no qual foram selecionados três neolignanas encontradas em Virola surinamensis (Rol.) Warb. para posterior estudo de Dinâmica Molecular e ensaio biológico contra a enzima cruzaína do T. cruzi.
Palavras chaves
Virola surinamensis; Doença de Chagas; cruzaína
Introdução
Segundo a Organização Mundial de Saúde (OMS), a doença de Chagas na América Latina afeta cerca 8 milhões de pessoas (ROMERO; LOPEZ, 2017). A doença de Chagas apresenta duas fases clínicas, uma aguda, assintomática, e outra crônica que é responsável pelas síndromes gastrointestinais. Contudo, apenas o nifurtimox e o benzonidazol são utilizados para o tratamento da doença (PALACE-BERL et al. 2013). Entretanto, os fármacos utilizados, apresentam uma significativa melhora somente na fase aguda da doença e em 40% dos pacientes causam efeitos adversos (DE OLIVEIRA et al. 2017). O desenvolvimento de estudos com o T. Cruzi vem permitindo a descoberta de compostos mais seletivos e eficazes a partir de alvos terapêuticos potenciais, tal como a cruzaína que é um membro mais abundante da família das cisteíno proteases, envolvida nos principais processos do ciclo de vida no parasito e no hospedeiro (PAULI et al. 2017). O emprego de plantas medicinais para a manutenção e a recuperação da saúde tem ocorrido ao longo dos tempos, desde as formas mais simples de tratamento local até as formas mais sofisticadas de fabricação industrial de medicamentos (LORENZI; MATOS, 2008). A espécie Virola surinamensis é facilmente encontrada na América Central e na América do Sul incluindo o Brasil, demonstrando um grande potencial biológico a partir dos constituintes químicos dessa espécie (BARATA, et. al., 1978; BORGES, et. al., 2007; SANTOS, et. al., 1996; LOPES, et. al., 1998; PAULO, 1983; ARRUDA, 1990; AGRAWAL & THAKUR, 1985).
Material e métodos
A escolha das neolignanas ocorreu através do estudo fitoquímico de folhas de Virola surinamensis, onde através de cromatografia clássica e CLAE (cromatografia líquida de alta eficiência), tornou-se possível o isolamento de 9 substâncias da classe das neolignanas, o fracionamento em coluna clássica ocorreu pela eluição de solventes por ordem crescente de polaridade. O isolamento por CLAE, ocorreu em eluição de modo reverso utilizando sistema Água/Acetonitrila em coluna com fase estacionária C18, com detector na faixa do UV em 280nm. As estruturas foram identificadas por RMN (Ressonância Magnética Nuclear) de 1H e 13C e comparação com dados existentes na literatura. Os estudos de modelagem molecular foram realizados com as nove neolignanas previamente isoladas das folhas de Virola surinamensis, com a enzima cruzaína do parasito T. cruzi e com a enzima humana Catepsina L, sendo que as estruturas cristalográficas foram recuperadas do Protein Data Bank (PDB). Para a escolha do programa foi realizado a redocagem da estrutura cristalográfica com 5 diferentes programas (Autodock 4.2.6, AutodockVina 1.1.2, Dock 6.7, Gold 5.5, e Fitted 2.6). Os comprimentos de ligação de hidrogênio foi obtida por meio do programa Chimera (PETTERSEN et al., 2004).
Resultado e discussão
Para selecionar o melhor programa para a docagem, dentre os cinco selecionados, realizou-se o processo chamado de redocagem do ligante cristalográfico da enzima cruzaína recuperada do PDB (Protein Data Bank) com o código 3I06. Pela avaliação dos valores de RMSD (valores de desvio quadrático médio - Root Mean Square Deviation) (Tabela 1) obtidos na redocagem molecular, observou-se que o programa Fitted 2.6 foi aquele que obteve o menor valor, sendo este selecionado para a docagem. Além da enzima do parasito foi selecionada também para o estudo de docagem a Catepsina L, que é a enzima homóloga humana com o código PDB 2XU3.
Na Tabela 2 são colocadas as numerações, mas as estruturas serão preservadas para serem avaliadas experimentalmente. Por meio da Tabelas 2 e na Tabela 3 é possível observar as interações das neolignanas na enzima cruzaína e na catepsina L, respectivamente.
Por meio da Tabela 2 observa-se os compostos 1, 3, 4, 5 e 7 apresentam um maior número de resíduos próximos (distâncias inferiores a 3 Ǻ) e fazem interações importantes com os resíduos Cys25 e GLY66 que formam a tríade catalítica da enzima cruzaína do T. cruzi (SAJID et al., 2011), sendo importante ressaltar que as moléculas não interagiram com a enzima homóloga humana.
Dentre os compostos selecionados verifica-se que a substância cp5 é uma neolignana tetraidrofurânica, que possui duas unidades fenilpropânicas ligadas por um átomo de oxigênio (WEINGES e SPANIG, 1967). Já as estruturas de cp6 e cp7 são neolignanas que possuem um esqueleto base 8.O.4´, desta forma essas estruturas podem servir como ponto de partida para o desenvolvimento de novos fármacos com atividade tripanossomicida.
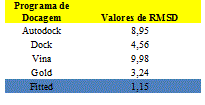
Resultados do RMSD da obtidos na redocagem molecular com os ligantes cristalográficos.
Interações
Conclusões
Com os estudos de modelagem molecular, através da técnica de docagem, foi possível selecionar três neolignanas encontradas em produtos naturais que podem ser utilizados como ponto de partida para o desenvolvimento de fármacos para a Doença de Chagas, sendo importante ressaltar que estudos de Dinâmica Molecular e ensaios in vitro serão efetuados para seleção de moléculas promissoras que possam atuar como inibidores da cruzaína na doença de Chagas.
Agradecimentos
Agradecimentos a CAPES e a UFPA
Referências
AGRAWAL, P. K.; THAKUR, R. S. 13C NMR spectroscopy of lignan and neolignan derivatives. Magnetic Resonance in Chemistry, v. 23, p.389, 1985.
ARRUDA, M. S. P. Flavonóides de Neoraputia alba (Rutaceae). Tese de Doutorado. UFSCar, 1990.
BARATA, L. E. S.; BAKER, P; GOTTLIEB, O. R; RÚVEDA, E. A. Neolignans of Virola surinamensis. Phytochemistry, v. 17, p. 783, 1978.
BORGES, F.C.; SANTOS, L.S.; CORRÊA, M.J.C.; OLIVEIRA, M.N.; SOUZA FILHO, A.P.S. Potencial alelopático de duas neolignanas isoladas de folhas de Virola surinamensis (Myristicaceae). Planta Daninha, v. 25, n. 1, p. 51-59, 2007.
CABRAL, M. M. O., BARBOSA-FILHO, J. M., MAIA, G. L. A., CHAVES, M. C. O., BRAGA, M. V., DE SOUZA, W., & SOARES, R. O. A. Neolignans from plants in northeastern Brazil (Lauraceae) with activity against Trypanosoma cruzi. Experimental parasitology, 124(3), 319-324. 2010.
DOYLE, P. S.; ZHOU, Y. M.; ENGEL, J. C.; MCKERROW, J. H. (2007). A cysteine protease inhibitor cures Chagas' disease in an immunodeficient-mouse model of infection. Antimicrobial agents and chemotherapy, 51(11), 3932-3939.
KÓNYA, K.; VARGA, Zs.; ANTUS, S. Antioxidant properties of 8. O. 4′-neolignans. Phytomedicine, v. 8, No.6, p. 454–459, 2001.
LOPES, N. P.; CHICARO, P.; KATO, M. J.; ALBUQUERQUE, S. YOSHIDA, M. Flavonoids and lignans from Virola surinamensis twig and their in vitro activity against trypanossoma cruzi. Planta Médica. V.64, p 667-669, 1998..
LORENZI, H. e MATOS, F.J.A. Plantas Medicinais no Brasil: nativas e exóticas. 2ª editora Nova Odessa: Plantarum, 2008.
JORGE, S. D., F. PALACE-BERL, K. F. M. PASQUALOTO, M. ISHII, A. K. FERREIRA, C. M. BERRA, R. V. BOSCH, D. A. MARIA AND L. C. TAVARES. "Ligand-based design, synthesis, and experimental evaluation of novel benzofuroxan derivatives as anti-Trypanosoma cruzi agents." European Journal of Medicinal Chemistry v. 64: 200-214, 2013.
PAULI, I.; Planejamento de inibidores da enzima cruzaína candidatos a fármacos para o tratamento da Doença de Chagas. Tese de Doutorado. Universidade de São Carlos. 2016.
PAULO, M. de Q. ESTUDO FITOQUÍMICO DAS FOLHAS DE Virola surinamensis E Osteophloeum platyspermum, Dissertação de Mestrado. Universidade Estadual de Campinas, 1983.
RODRIGUES, R. P., MANTOANI, S. P., DE ALMEIDA, J. R., PINSETTA, F. R., SEMIGHINI, E. P., da Silva, V. B., & da Silva, C. H. T. (2012). Estratégias de triagem virtual no planejamento de fármacos. Revista Virtual de Química, 4(6), 739-776.
ROMERO, A. H., LÓPEZ, S. E. "In silico molecular docking studies of new potential 4-phthalazinyl-hydrazones on selected Trypanosoma cruzi and Leishmania enzyme targets". Journal of Molecular Graphics and Modelling, v. 76: 313-329, 2017.
SANTOS, L. S. et al. Constituents from the leaves of Virola michelli. Fitoterapia, v.67, No..6, p.555-6,1996.
SERAFIM, R. A. M., T. F. DE OLIVEIRA, A. P. M. LOUREIRO, R. KROGH, A. D. ANDRICOPULO, L. C. DIAS AND E. I. FERREIRA. "Molecular modeling and structure-activity relationships studies of bioisoster hybrids of N-acylhydrazone and furoxan groups on cruzain." Medicinal Chemistry Research v. 26(4): 760-769, 2017.
STIERAND, K., & RAREY, M. PoseView--molecular interaction patterns at a glance. Journal of cheminformatics, 2(1), P50. 2010.
WHO - World Health Organization. Distribution of cases of Trypanossoma cruzi infection. 2009.
WEINGES, K.; SPANIG, R. Lignans and cyclolignans. Oxidative coupling of phenols. New York, Marcel Dekker, Inc., 1967.
LEITE, A. C. L.; LIMA, R. S.; MOREIRA, D. R. M.; CARDOSO, M. V. O.; BRITO, A. C. G.; SANTOS, L. M. F.; HERNANDES, M. Z.; KIPERSTOK, A. C.; LIMA, R. S.; SOARES, M. B. Bioorg. Med. Chem. 2006, 14, 3749.











