AVALIAÇÃO DO TEOR DA DUREZA DA ÁGUA DE ABASTECIMENTO PÚBLICO
ISBN 978-85-85905-23-1
Área
Química Analítica
Autores
Pereira Santos, S. (UFPA) ; Pereira Franco, C.J. (UFPA) ; Cunha de Sá, E.W. (UFPA) ; Oliveira Ribeiro, M.V. (UFPA) ; Soares Costa, K.L. (UFPA) ; Serra da Costa, T. (UFPA) ; Tavares Pinheiro, M.H. (UFPA)
Resumo
O sabor desagradável em águas de consumo pode ser causado pela presença de sais de íons cálcio (Ca2+) e magnésio (Mg2+) em elevados níveis de concentração. Neste estudo utilizou-se águas da torneira da zona urbana da capital de Belém-PA, a fim de verificar se essas amostras estão dentro dos padrões desejados de dureza da água de abastecimento, empregando análise volumétrica por complexação. Os resultados das análises das amostras dos 4 bairros distintos apontam que as mesmas estão dentro da faixa recomendável de padrão de aceitação para consumo humano.
Palavras chaves
Água de abastecimento; Dureza; Potabilidade
Introdução
A determinação da dureza é um parâmetro característico da qualidade de águas para uso doméstico e industrial (SKOOG, 2012), sendo que são admitidos valores típicos de águas duras ou muito duras. Denomina-se dureza total a soma das durezas individuais atribuídas à presença de íons cálcio e magnésio (PINTO, 2005). Assim, os principais íons causadores de dureza são cálcio e magnésio. A composição química da água e, portanto, a sua dureza, depende em grande parte do solo da qual procede. Assim, águas brandas são encontradas em solo basáltico, areníferos e graníticos, enquanto que águas que precedem de solos calcários apresentam frequentemente durezas elevadas (PINTO, 2005). A determinação da dureza da água geralmente é feita por meio de uma titulação com EDTA após a amostra ter sido tamponada a pH 10. O magnésio, que forma o complexo menos estável com EDTA, dentre todos os cátions multivalentes comuns nas amostras típicas de água, não é titulado até que tenha sido adicionado reagente suficiente para complexar todos os outros cátions na amostra. Portanto, um indicador para o íon magnésio, como a calmagita ou Negro de Eriocromo T, pode servir como indicador nas titulações de água dura. Frequentemente, uma pequena quantidade de quelato magnésio-EDTA é incorporada no tampão ou no titulante para assegurar a presença de íons magnésio suficiente para uma ação satisfatória do indicador (SKOOG, 2012). Face ao exposto esse trabalho teve como objetivo determinar a dureza da água de alguns bairros de Belém/Pa e avaliar se as mesmas estão em conformidade com o padrão de aceitação para consumo humano.
Material e métodos
Esta atividade foi desenvolvida no 2º período de 2018, em uma turma do 3º semestre do curso de Química Industrial-UFPA na disciplina Análise Química Qualitativa (EN03045), visando efetuar uma relação entre os métodos de identificação de íons estudados e sua aplicação na análise de uma amostra do cotidiano, como a determinação da dureza da água e sua relação com a potabilidade. A amostra selecionada foi água de abastecimento público de quatro bairros da região metropolitana de Belém, denominados de amostra 1, 2, 3 e 4, foram armazenadas em garrafas de 250 mL devidamente esterilizadas e as análises efetuadas no mesmo dia da coleta. Inicialmente foi efetuada a análise qualitativa para os íons Ca+2 e Mg2+, posteriormente, efetuou-se a análise quantitativa empregando a volumetria por complexação na determinação da dureza total da água. As amostras foram alcalinizadas com solução tampão amoniacal de pH 10 e adicionou-se uma pitada do indicador metalocrômico negro de eriocromo T, e efetuou-se a titulação com solução padrão de EDTA 0,02 mol/L, e realizaram-se a análise utilizando alíquotas de 50,0 mL de cada amostra em triplicata e os valores utilizados nos cálculos foram a média dos resultados obtidos nas análises, expressos em mg/L de CaCO3.
Resultado e discussão
A Tabela 1 apresenta os resultados obtidos para análise do teor de CaCO3 em
cada amostra analisada e compara com a dureza total permitida pela Portaria MS
nº 518/2004. As amostras 1 e 2, podem ser consideradas águas moles, com
possibilidade de uso em processos industriais, comparadas às amostras 3 e 4
consideradas moderadamente duras. Verifica-se que todas as amostras
apresentaram dureza dentro dos valores permitidos.
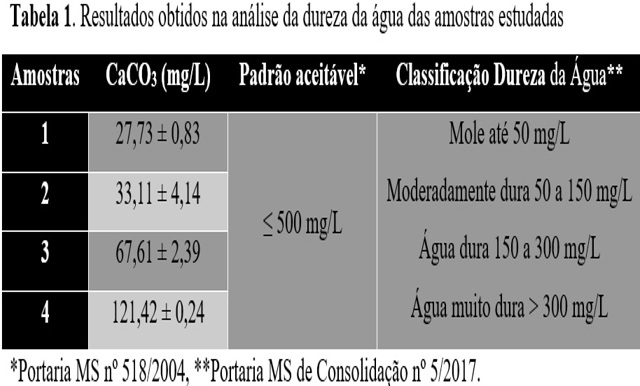
É uma tabela, referente aos resultados obtidos na analise da dureza da água das amostras e o seu desvio padrão.
Conclusões
Os resultados obtidos permitem concluir que os valores encontrados estão de acordo com o padrão estabelecido pela legislação vigente, e nenhuma das amostras possuem riscos para a saúde humana. O desenvolvimento do experimento empregando amostras de uso cotidiano despertou o interesse e facilitou o aprendizado do conteúdo abordado.
Agradecimentos
Agradecemos pela oportunidade de participar dessa pesquisa e a nossa orientadora Marta, por toda sua atenção e dedicação e esforço para que nós pudéssemos ter a confiança e a segurança na realização deste trabalho.
Referências
SKOOG, D. A.; WEST, D. M.; HOLLER, F. J. Fundamentos de Química Analítica, São Paulo: Pioneira Thomson Learnind, 2012.
PINTO, G.M. Química Analítica Quantitativa. Creative Commons, 2005.
BRASIL. Ministério da Saúde. Portaria de Consolidação nº 5, 28/09/2017. ANEXO 10 do ANEXO XX.
BRASIL. Ministério da Saúde. Portaria nº 518, 05/08/2004.











