Validação de metodologia para detecção e quantificação de clozapina via cromatografia líquida de alta eficiência
ISBN 978-85-85905-23-1
Área
Química Analítica
Autores
Santana, R.M.R. (UFPE) ; Nascimento, G.E. (UFPE) ; Ribeiro, B.G. (UFPE) ; Napoleão, D.C. (UFPE) ; Duarte, M.M.M.B. (UFPE)
Resumo
Uma vez que as indústrias farmacêuticas têm contribuído com a poluição dos corpos hídricos, é importante o desenvolvimento de técnicas analíticas capazes de detectar e quantificar fármacos em diferentes matrizes ambientais. O presente estudo permitiu validar uma metodologia para identificação da clozapina, através de equipamento de cromatografia líquida de alta eficiência (CLAE). O processo de validação foi realizado conforme exigências de órgãos regulamentadores, nos quais foram avaliados diferentes parâmetros, dentre eles: linearidade, precisão, exatidão, limite de detecção e quantificação. A metodologia utilizada pode ser dita como confiável, visto que atende aos parâmetros mínimos de exigência para validação do método analítico, tendo apresentado resultados consistentes.
Palavras chaves
Clozapina; Cromatografia Líquida ; Validação
Introdução
A crescente expansão urbana e industrial dos últimos anos tem contribuído de forma significativa para a contaminação dos recursos naturais, sobretudo dos recursos hídricos. Este fato está relacionado com a presença de alguns compostos químicos em matrizes aquáticas, que podem causar danos aos seres vivos (PAÍGA et al, 2014; CHRISTOU et al, 2017; EBELE; ABDALLAH; HARRAD, 2017). Embora seus efeitos perante o meio ambiente e a saúde humana e de animais ainda sejam pouco conhecidos, existe comprovação de suas consequências sobre o sistema endócrino e imunológico desses seres (BORGES et al, 2016). Dentre estes contaminantes estão diferentes classes de poluentes orgânicos persistentes, como os fármacos (RODRIGUEZ- NARVAEZ et al, 2017; GEISSEN et al, 2015). A presença de compostos farmacêuticos no ambiente advém da sua excreção após acentuado e extensivo uso no tratamento de doenças, bem como da atividade industrial de fabricação de fármacos e do descarte inadvertido desses produtos quando expirado o prazo de validade (SILVA; COLLINS, 2011). Tendo em vista a quantidade já existente e a elaboração de tantas outras substâncias terapêuticas a cada dia, a identificação e quantificação desses contaminantes não se dão de forma simples (BIALK-BIELINSKA et al, 2016). Neste sentido, com o objetivo de executar uma correta avaliação, assim como identificação e quantificação de resíduos farmacêuticos, em diferentes níveis de concentração no meio ambiente, faz-se necessário o desenvolvimento de metodologias analíticas seletivas, sensíveis, exatas e precisas (PAÍGA; SANTOS; DELERUE-MATOS, 2017). Na literatura são relatados variados métodos analíticos para a determinação de fármacos em matrizes aquáticas. Dentre as técnicas utilizadas para tal fim, encontra-se a cromatografia líquida de alta eficiência (CLAE) (ASHFAQ et al, 2017; OLIVEIRA et al, 2015; PATROLECCO et al, 2013). A cromatografia é uma técnica de separação físico-química sensível e seletiva, que abrange diferentes compostos (SILVA; COLLINS, 2011; MALDANER; COLLINS; JARDIM, 2010). Para a quantificação dos analitos de interesse é necessária uma escolha correta do detector, visto que este irá medir as mudanças de concentração das substâncias (PONTES et al, 2013; SKOOG et al, 2014). Estudos recentes têm empregado a detecção ultravioleta (UV) para determinações de compostos farmacêuticos em matrizes aquosas (OLIVEIRA et al, 2015; NAPOLEÃO et al, 2018). Neste contexto, encontram-se descritos na literatura diversos empregos deste tipo de técnica cromatográfica com detecção de UV, para identificar e quantificar substâncias farmacêuticas de diferentes classes, tais como: antipiréticos, antiinflamatórios, antipsicóticos, antibióticos e antirretrovirais (ASHFAQ et al, 2017; OLIVEIRA et al, 2015; PATROLECCO et al, 2013). O desenvolvimento de métodos analíticos para determinação da concentração de compostos de interesse compreende a avaliação e otimização de algumas condições, tais como: fase móvel, fluxo da fase móvel e temperatura de trabalho da coluna cromatográfica (SKOOG et al, 2014; AQUINO NETO; NUNES; 2003). O desenvolvimento de metodologias rápidas e confiáveis para análises quantitativas de fármacos são de grande interesse, de modo a reduzir os custos e tempos de análise. Uma vez elaborada uma metodologia para a análise pretendida, esta deve ser avaliada através de alguns parâmetros de validação, a fim de garantir resultados seguros. Deste modo, a validação de um método analítico é definida como o ato de assegurar que este, irá conduzir a resultados confiáveis (BRASIL, 2003). Neste sentido, a Resolução de n° 899, de 29 de maio de 2003, da Agência Nacional de Vigilância Sanitária (ANVISA), apresenta um guia para validação de métodos analíticos e bioanalíticos, para assegurar, por meio de ensaios experimentais, que o método utilizado atenda às exigências das agências reguladoras (BRASIL, 2003). No Brasil, além da ANVISA, o Instituto Nacional de Metrologia, Normatização e Qualidade Industrial do Brasil (INMETRO), através do documento DOQ-CGCRE-008, de agosto de 2016 (revisão 05), também discorre com relação a orientações sobre validação de métodos analíticos, para garantir que o mesmo tenha características adequadas para a obtenção de resultados com a qualidade exigida (INMETRO, 2016). Alguns dos parâmetros fundamentais para validação de um método analítico são: linearidade, precisão, exatidão, limite de detecção (LD) e limite de quantificação (LQ) (RIBANI et al, 2004). Diante do exposto o objetivo deste trabalho foi avaliar a confiabilidade analítica de uma metodologia para detecção e quantificação do fármaco clozapina via cromatografia líquida de alta eficiência. Tal avaliação foi realizada a partir da análise dos parâmetros de linearidade, precisão, exatidão, limite de detecção e limite de quantificação.
Material e métodos
Inicialmente, foi preparada uma solução estoque contendo 100 mg∙L-1 do princípio ativo do fármaco clozapina (CLZ) utilizando acetonitrila (Merck) e água acidificada com ácido acético 0,1%. Em seguida, esta solução foi filtrada através de uma membrana Millipore 0,22 μm (Merck). As concentrações do fármaco em solução foram determinadas através de equipamento de CLAE (Shimadzu) com sistema de detecção de ultravioleta/visível (UV/Vis) ajustado para 220 e 292 nm. A coluna cromatográfica empregada foi do tipo ULTRA C18 de fase reversa, com tamanho de partícula de 5μm, e dimensões 4,6 mm x 250 mm. A fase móvel utilizada foi composta por acetonitrila e solução de água acidificada com ácido acético 0,1% (50:50; v/v), a um fluxo de 0,90 mL∙min-1, e temperatura da coluna de 40°C. A etapa de validação seguiu as exigências do Instituto Nacional de Metrologia, Qualidade e Tecnologia (INMETRO) (INMETRO, 2016) e da Agência Nacional de Vigilância Sanitária (ANVISA) (BRASIL, 2003). Para isso, foram contemplados alguns parâmetros, dentre eles: linearidade, precisão, exatidão e os limites de detecção (LD) e quantificação (LQ). Preliminarmente, através de diluições da solução estoque, foi construída uma curva analítica com 12 diferentes concentrações, com faixa linear de 1 a 20 mg∙L-1. A linearidade do método foi observada por meio da leitura de 7 replicatas desta curva analítica, para posterior obtenção do gráfico da média das áreas dos picos em função da sua concentração teórica, estando seu cálculo baseado na equação da regressão linear, obtida a partir do método dos mínimos quadrados. No entanto, de forma precedente à análise de linearidade, foi verificada a inexistência de valores anômalos (outliers) para as áreas obtidas em cada nível de concentração. Para tal, foi realizada uma análise estatística dos dados através do teste de Grubbs. A análise de precisão baseou-se no cálculo do desvio padrão relativo, comumente denominado por coeficiente de variância (CV). Este foi obtido através da determinação do desvio padrão absoluto das réplicas de cada ponto da curva dividido pela média das mesmas. Já no estudo da exatidão foi utilizado o método da recuperação por fortificação da amostra, em que foram utilizadas soluções diluídas de uma mesma solução estoque. Neste caso, a exatidão foi verificada a partir de 9 determinações, as quais contemplavam a faixa linear do método analítico em 3 diferentes níveis de concentração (11,0; 15,0 e 17,0 mg∙L-1), com 3 réplicas em cada nível. A determinação deste parâmetro foi expressa pela relação percentual de recuperação do analito de concentração conhecida adicionado à amostra, conforme DOC-CGCRE-008 do INMETRO (2016). Ainda neste estudo, os limites de detecção (LD) e quantificação (LQ) do método foram definidos através de parâmetros da curva analítica, como predito por Ribani et al (2004).
Resultado e discussão
De acordo com a análise da Figura 2(a) verificou-se que os valores obtidos
para G< e G> dos dados experimentais encontram-se em
conformidade com o aceitável e equivalente a 90% de confiança para sete
medições. Fato este pode ser constatado uma vez que todos os valores do
teste se mostraram inferiores a 1,938, conforme preconizado por Grubbs e
Beck (1972). Tendo em vista a uniformidade dos valores obtidos para as áreas
das diferentes concentrações estudadas, pôde-se então avaliar a linearidade
do método. Este parâmetro foi determinado com base na construção das curvas
analíticas supracitadas. A média de tais curvas encontra-se representada na
Figura 2(b), assim como a equação da reta e o valor do coeficiente de
correlação de Pearson (r).
Conforme pode ser observado na Figura 2(b), o método pode ser considerado
linear uma vez que o valor de r atende aos padrões recomendados pelos órgãos
regulamentadores, encontrando-se superior a 0,90 conforme exigido pelo
INMETRO (INMETRO, 2003), bem como a 0,99 como requerido pela ANVISA (BRASIL,
2003). A avaliação da precisão foi realizada sob condições de
reprodutibilidade através da análise do percentual do CV. Os valores de CV
foram determinados com base nos dados obtidos para todas as concentrações
empregadas das sete replicatas, tendo sido verificado que para todas as
concentrações analisadas, o CV (%) encontrou-se inferior a 20%, valor este
exigido para métodos de análise de traços/impurezas e de substâncias
complexas como fármacos, conforme descrito pela ANVISA (2003). Sendo assim,
é possível afirmar que o método adotado é preciso.
Já a exatidão foi avaliada comparando-se os valores obtidos
experimentalmente com os previstos a partir do estudo da recuperação, no
qual uma quantidade conhecida do padrão foi adicionada à amostra. Tal
determinação se deu através da análise de três concentrações na faixa linear
pré-estabelecida; as médias do percentual de recuperação e os valores de
CV(%) correspondentes aos resultados em triplicata foram, respectivamente:
102,09% e 0,68% para a concentração de 11,0 mg·L-1; 95,59% e
0,24% para 15,0 mg·L-1; e 100,11% e 0,23% para 17,0
mg·L-1. Sendo assim, constatou-se que os percentuais de
recuperação obtidos a partir da amostra do fármaco alcançaram valores
elevados, variando entre 95 e 102% com valores de CV relativamente baixos, o
qual foi determinado com base nas triplicatas realizadas.
Baseado nisto, pode-se afirmar que o método está de acordo com o
estabelecido pela ANVISA (2003), uma vez que são requeridos percentuais de
recuperação próximos a 100% e valor de CV menores a 20% para o nível de
concentração em estudo. Ainda neste sentido, Perlati et al (2012)
consideram coerentes valores entre 70 e 120% para recuperação através da
fortificação de amostras complexas, como é o caso do fármaco CLZ. Deste
modo, tendo em vista tais considerações, o método analítico pode ser
considerado exato.
Por fim, de forma a determinar o menor valor da concentração do analito que
pode ser detectada e quantificada com segurança através do método empregado,
foram calculados os limites de detecção e quantificação do mesmo. Para isso,
foram utilizados valores de dez replicatas da amostra de menor concentração
aceitável, no caso 1 mg∙L-1. Sendo assim, verificou-se que para o
método empregados os valores de LD e LQ foram respectivamente 0,13
mg∙L-1 e 0,41 mg∙L-1.
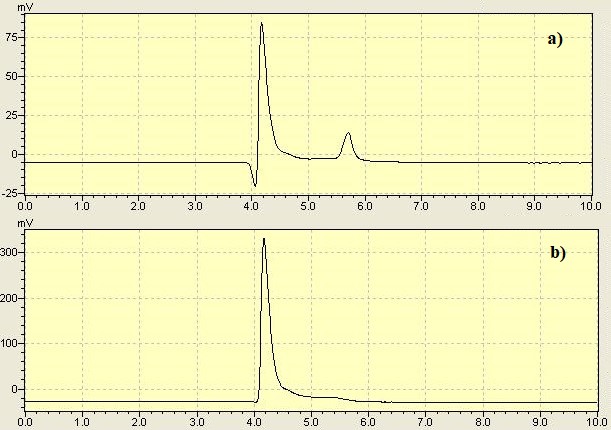
Cromatogramas para padrão de clozapina a 100 mg.L- 1 nos comprimentos de onda: a) 220 nm e b) 292 nm.
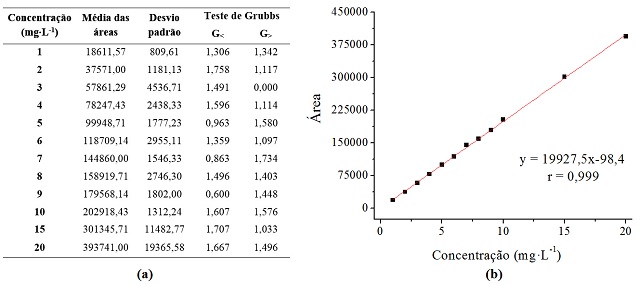
(a) Médias das áreas das curvas e respectivos desvios-padrão e valores do teste de Grubbs; (b) Curva analítica para quantificação da clozapina.
Conclusões
A metodologia analítica para quantificação da clozapina via CLAE com detector UV mostrou-se viável e segura, uma vez que os parâmetros analíticos de validação analisados apresentaram resultados em conformidade com as condições impostas pelos órgãos competentes ANVISA e INMETRO. A mesma apresentou boa linearidade na faixa de concentração proposta (r = 0,999), e mostrou-se exata e precisa, assegurando a confiabilidade dos resultados. Foram determinados também os limites de quantificação e de detecção, indicando que a metodologia é eficiente para quantificar o fármaco em uma concentração mínima de 0,41 mg∙L-1.
Agradecimentos
À FACEPE e à CAPES pelas concessões das bolsas; ao NUQAAPE/FACEPE e a FADE/UFPE pelo suporte financeiro.
Referências
AQUINO NETO, F. R.; NUNES, D. S. S. Cromatografia - Princípios básicos e técnicas afins. 1 ed. Rio de Janeiro: Interciência, 2003.
ASHFAQ, M.; KHAN, K. N.; REHMAN, M. S. U.; MUSTAFA, G.; NAZAR, M. F.; SUN, Q.; IQBAL, J.; MULLA, S. I.; YU, C. P. Ecological risk assessment of pharmaceuticals in the receiving environment of pharmaceuticals wastewater in Pakistan. Ecotoxicology and Environmental Safety, v. 136, p. 31-39, 2017.
BIALK-BIELINSKA, A.; KUMIRSKA, J.; BORECKA, M.; CABAN, M.; PASZKIEWICZ, M.; PAZDRO, K.; STEPNOWSKI, P. Selected analytical challenges in the determination of pharmaceuticals in drinking/marine waters and soil/sediment samples. Journal of Pharmaceutical and Biomedical Analysis, v. 121, p. 271-296, 2016.
BIENIEK, D. D.; BESSEGATO, T. C.; SANSONE, P. E. S.; DALLA COSTA, T.; GUTERRES, S. S.; CONRADO, D. J.; HAAS, S. E. Validação de metodologia analítica por cromatografia líquida de alta eficiência para doseamento de clozapina em nanopartículas poliméricas. Perspectiva, v. 35, n. 129, p. 17-26, 2010.
BORGES, R. M.; MINILLO, A.; DE MACEDO LEMOS, E. G.; DO PRADO, H. F. A.; TANGERINO, E. P. Uso de filtros de carvão ativado granular associado a microrganismos para remoção de fármacos no tratamento de água de abastecimento. Engenharia sanitária e ambiental, v. 21, n. 4, p. 709-720, 2016.
BRASIL. AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Resolução nº 899, de 29 de maio de 2003. Guia para validação de métodos analíticos e bioanalíticos. Diário Oficial da União, Brasília, 02 de junho de 2003.
CHRISTOU, A.; KARAOLIA, P.; EVROULA, H. MICHAEL, C.; FATTA-KASSINOS, D. Long-term wastewater irrigation of vegetables in real agricultural systems: Concentration of pharmaceuticals in soil, uptake and bioaccumulation in tomato fruits and human health risk assessment. Water Research, v. 109, p. 24-34, 2017.
EBELE, A. J.; ABDALLAH, M. A-E.; HARRAD, S. Pharmaceuticals and personal care products (PPCPs) in the freshwater aquatic environment. Emerging Contaminants, v. 3, n. 1, p. 1-16, 2017.
GEISSEN, V.; MOL, H.; KLUMPP, E.; UMLAUF, G.; NADAL, M.; VAN DER PLOEG, M.; VAN DE ZEE, S., RITSEMA, C. J. Emerging pollutants in the environment: a challenge for water resource management. International Soil and Water Conservation Research, v. 3, p. 57-65, 2015.
GRUBBS, F. E.; BECK, G. Extension of sample sizes and percentage points for significance tests of outlying observations. Technometrics, v. 14, n. 4, p. 847-854, 1972.
INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA – (INMETRO). DOC-CGCRE-008 Orientação sobre validação de métodos analíticos. 2003.
INSTITUTO NACIONAL DE METROLOGIA, QUALIDADE E TECNOLOGIA – (INMETRO). DOC-CGCRE-008 Orientação sobre validação de métodos analíticos. Revisão 05, 2016.
LIU, Y.Y.; DOUDE VAN TROOSTWIJK, L.J.A.E.; GUCHELAAR, H.J. Simultaneous determination of clozapine, norclozapine and clozapine-N-oxide in human plasma by high-performance chromatography with ultraviolet detection. Biomedical Chromatography, v. 15, p. 280-286, 2001.
MALDANER, L.; COLLINS, C. H.; JARDIM, I. C. S. F. Fases estacionárias modernas para cromatografia líquida de alta eficiência em fase reversa. Química Nova, v. 33, n.7, 2010.
MERCOLINI, L. BUGAMELLI, F.; KENNDLER, E.; BONCOMPAGNI, G.; FRANCHINI, L.; RAGGI, M. A. Simultaneous determination of the antipsychotic drugs levomepromazine and clozapine and their main metabolites in human plasma by a HPLCUV method with solid-phase extraction. Journal of Chromatography B, v. 846, p. 273-280, 2007.
NAPOLEÃO, D. C.; ZAIDAN, L. E. M. C.; DIAZ, J. M. R.; SANTANA, R. M. R.; MONTENEGRO, M. C. B.; ARAUJO, A. N.; BENACHOUR, M.; SILVA, V. L. Use of the photo-Fenton process to discover the degradation of drugs present in water from the Wastewater Treatment Plants of the pharmaceutical industry. Afinidad, v. 75, p. 19-27, 2018.
PAÍGA, P.; LOLIC, A.; HELLEBUYCK, F.; SANTOS, L. H. M. L. M.; CORREIA, M. MATOS, C. D. Development of a SPE-UHPLC-MS/MS methodology for the determination of non-steroidal anti-inflammatory and analgesic pharmaceuticals in seawater. Journal of Pharmaceutical and Biomedical Analysis, v. 14, p. 305-307, 2014.
PAÍGA, P.; SANTOS, L. H. M. L. M.; MATOS, C. D. Development of a multi-residue method for the determination of human and veterinary pharmaceutical and some of their metabolites in aqueous environmental matrices by SPE-UHPLC-MS/MS. Journal of Pharmaceutical and Biomedical Analysis, v. 135, p. 75-86, 2017.
PATROLECCO, L.; ADEMOLLO, N.; GRENNI, P.; TOLOMEI, A.; CARACCIOLO, A. B.; CAPRI, S. Simultaneous determination of human pharmaceuticals in water samples phase extraction and HPLC with UV-fluorescence detection. Microchemical Journal, v. 107, p. 165-171, 2013.
PERLATTI, B.; SILVA, M. F. G. F.; FERNANDES, J. B.; FORIM, M. R. Validation and application of HPLC–ESI-MS/MS method for the quantification of RBBR decolorization, a model for highly toxic molecules, using several fungi strains. Bioresource Technology, v. 124, p. 37-44, 2012.
PONTES F. L. D; PONTAROLO, R.; CAMPOS, F. R.; GASPARETTO, J. C.; CARDOSO, M. A.; PIANTAVINI, M. S.; TRINDADE, A. C. L. B. Development and validation of an HPLC-MS/MS method for simultaneous determination of Ivermectin, Febantel, Praziquental, Pyrantelpamoate and related compounds in fixed rate combination for veterinary use. Asian Journal of Pharmaceutical and Clinical Research. v. 6, n. 2, p.191-200, 2013.
RIBANI, M.; BOTTOLI, C. B. G.; COLLINS, C. H.; JARDIM, I. C. S. F.; MELO, L. F. C. Validação em métodos cromatográficos e eletroforéticos. Química Nova, v. 27, n. 5, p. 771-780, 2004.
RODRIGUEZ-NARVAEZ, O. M.; PERALTA-HERNANDEZ, J. M.; GOONETILLEKE, A.; BANDALA, E. R. Treatment Technologies for emerging contaminants in water: A review. Chemical Engineering Journal, v. 323, p. 361-380, 2017.
SHEN, Y. L. WU, H. L.; KO, W. K.; WU, S. M. Simultaneous determination of clozapine, clozapine N-oxide, Ndesmethylclozapine, risperidone, and 9-hydroxyrisperidone in plasma by high performance liquidchromatography with ultravioleta detection. Analytica Chimica Acta, v. 460, p. 201-208, 2002.
SKOOG, A. D.; WEST, D. M.; HOLLER, F. J. Fundamentos de química analítica. 9 ed. São Paulo: Cengage Learning, 2014.
SILVA, C. G. A.; COLLINS, C. H. Aplicações de cromatografia líquida de alta eficiência para o estudo de poluentes orgânicos emergentes. Química Nova, v. 34, n. 4, p. 665-676, 2011.











