Uso de Quitosana e Carboximetilquitosana como coagulantes de águas de elevada turbidez
ISBN 978-85-85905-23-1
Área
Ambiental
Autores
Flavia Oliveira Monteiro da, A. (UECE) ; Lima Junior, R.N. (UECE)
Resumo
Neste trabalho estudou-se a ação coagulante da quitosana (QUI) e carboximetilquitosana (CMQ) sobre águas de alta turbidez, através de comparativo usando sulfato de alumínio como padrão de referência. A CMQ foi produzida através da reação de síntese de éteres de Williamson e caracterizada por titulação potenciométrica e FTIR. Os testes coagulantes foram realizados em equipamento jar-test utilizando água sintética previamente caracterizada. Observou-se eficiências de remoção de turbidez e cor acima de 99% para os biocoagulantes, aplicando dosagens de 6 a 10 vezes menores do que o padrão e com menor volume de sólidos sedimentáveis. Desta forma, conclui-se que a QUITOSANA e a CMQ são biomateriais promissores como coagulantes de aguas turbulentas para aplicações in natura.
Palavras chaves
quitosana; carboximetilquitosana; biocoagulantes
Introdução
Um dos principais parâmetros físico-químicos avaliados no tratamento e na qualidade das águas naturais é a turbidez, caracterizada pela presença de materiais em suspensão (argila, silte, lodo, matéria orgânica e micro- organismos em excesso) que provocam a absorção e/ou dispersão da luz. Este parâmetro pode ser drasticamente aumentado em decorrência de fenômenos naturais, tais como enchentes, tempestades e tufões, ou em consequência de atividades antropogênicas, como lançamentos de esgotos domésticos e industriais e derramamentos de rejeitos de mineração em corpos hídricos (HU et al., 2013). A turbidez das águas pode ser classificada em baixa (menor que 50 NTU), média (50-100 NTU), alta (100-200 NTU) e muito alta (acima de 300 NTU). Nas águas naturais, elevados níveis de turbidez podem interferir nas reações fotossintéticas essenciais ao equilíbrio do ecossistema. A eficiência e segurança dos processos de potabilização de águas destinadas ao abastecimento público é tal qual menores forem os níveis de turbidez residual, principalmente do ponto de visto microbiológico (RICHTER; AZEVEDO NETO, 1991; ALTAHER, 2012). Sais inorgânicos, tais como sulfato de alumínio, cloreto férrico, sulfato ferroso e policloreto de alumínio, são utilizados rotineiramente como coagulantes para tratamento de águas. Uma preocupação atual é o residual destes elementos na água tratada, sobretudo o alumínio. Diversos estudos apontam para os malefícios da exposição humana a este metal, correlacionando-o com doenças neurodegenerativas como a Doença de Alzheimer (POLIZZI et al., 2002; BANKS et al., 2006; WALTON, 2013). O aumento da complexidade dos poluentes presentes nas águas naturais destinadas ao consumo humano estimulou também o desenvolvimento de novas tecnologias de tratamento. Sistemas de filtração por membrana (ultrafiltração, microfiltração e nanofiltração) têm sido aplicados com sucesso na remoção de micro-organismos e particulado coloidal em suspensão. Plantas de osmose reversa possibilita ainda a produção de água potável a partir de água do mar ou salobra (amplamente utilizadas em Israel), redução do teor de íons Ca2+ e Mg2+ (responsáveis pela dureza da água) e matéria orgânica dissolvida, além da remoção de poluentes específicos, como pesticidas, nitratos, produtos farmacêuticos e radionuclídeos (HOWE et al., 2016). Nos ultimos anos têm sido propostos na literatura biomateriais naturais como biocoagulantes. A quitosana é um copolímero linear formado por unidades de D-glucosamina e N-acetil-D-glucosamina, obtido através da reação de desacetilação em meio alcalino da quitina, um dos polissacarídeos mais abundantes do planeta. O crescente interesse pelo uso da quitosana como coagulante para o tratamento de águas (de abastecimento e residuais) baseia- se nas diversas vantagens operacionais e ambientais que podem ser obtidas, como a eficiência em águas frias, uso em menores dosagens, quando comparado aos coagulantes inorgânicos, e produção de um menor volume de lodo, mais denso e biodegradável (ROUSSY et al.,2005; KURITA, 2006; BOLTO; GREGORY, 2007; RENAULT et al., 2009; YANG et al., 2016). Como desvantagem, a quitosana apresenta solubilidade limitada a meios ácidos, tipicamente com pH menor que 6,5. As modificações estruturais do polímero surgem como metodologia para otimização das propriedades dos materiais derivados. Um dos mais estudados atualmente é a carboximetilquitosana (CMQ), obtida pela inserção de grupamentos carboximetílicos (-CH2-COOH) em substituição aos hidrogênios presentes em grupos amino (-NH2) e em hidroxilas (-OH), abundantes na estrutura da quitosana. A CMQ apresenta como vantagens a solubilidade numa ampla faixa de pH, baixa toxicidade, biodegradabilidade, capacidade de formação de géis e inibição sobre o desenvolvimento de biofilmes bacterianos (BORSAGLI, 2015; SILVA, 2015). Desta forma, o desenvolvimento de novos biocoagulantes são promissores a fim de buscar um produto de alta eficiencia de remoção de cor e turbidez eliminando os indesejáveis produtos tóxicos residuais presente nos processos de tratamento de água convencionais. Neste trabalho objetiva-se estudar a ação coagulante deste biocomposto sobre água sintética de turbidez muito alta, avaliando a eficiência da remoção de cor aparente, turbidez, sólidos sedimentáveis e sua influência sobre a condutividade elétrica, alcalinidade e pH do meio. Em paralelo, faz-se um comparativo de eficiência operacional entre quitosana, sulfato de alumínio e carboximetilquitosana, um derivado estrutural obtido via reação de eterificação da quitosana, resultante da reação desta com ácido monocloracético em meio fortemente alcalino.
Material e métodos
Síntese da Carboximetilquitosana Carboximetilquitosana (CMQ) foi obtida conforme metodologia descrita por Abreu (2008), através da reação de síntese éteres de Williamson, onde 1g de quitosana (QUI) (Polymar-Brasil), suspensa em isopropanol, reagiu com 6g de ácido monocloracético (C2H3O2Cl) em meio fortemente alcalino (NaOH), durante 4h a uma temperatura de 60° C e sob agitação constante. O produto obtido foi lavado sucessivamente com etanol (80% e 90%) e metanol P.A. e seco em estufa à 60°C durante 24h. Caracterização potenciométrica da QUI e CMQ A titulação potenciométrica foi utilizada para o cálculo dos graus de desacetilação (G.D.) e substituição (G.S.) da QUI e CMQ sintetizada, respectivamente, conforme as Equações 1 e 2 descritas na literatura (ALVES, 2008; ABREU, 2008), baseando-se na reação entre KOH e cada biopolímero, dissolvido previamente em HCl. G.D.QUI %=MKOH*V2-V1*161mQUI*100 (1) G.S.CMQ (%) =161 x (MKOH x VKOH)mCMQ- 58 x (MKOH x VKOH) (2) Onde: MKOH e VKOH são a molaridade e o volume de solução de base titulante (KOH), (V2-V1) é o volume, em litros, da solução de base consumida entre o primeiro e o segundo pontos de equivalência da titulação, mQUI e mCMQ, são as massas de QUI e CMQ (g) utilizadas e 161 e 58 são as massas molares das unidades repetitivas da QUI (D-glucosamina) e dos grupos carboximetílicos titulados (-CH2-COO-), respectivamente. Espectroscopia de Infravermelho com Transformada de Fourier (FT-IR) Avaliou-se o grau de desacetilação (GD) da QUITOSANA, a eficiência da reação de carboximetilação e o grau de substituição (GS) do produto formado em um espectrofotômetro modelo Nicolet iS5 da Thermo Scientific, usando pastilhas de KBr na proporção 1:20 (m/m). O G.D da QUI e o G.S da CMQ foram calculados com base nas Equações 3 e 4 propostas nas metodologias de Brugnerotto et al. (2001) e Borsagli (2015): G.D%QUI =100-31.92*A1.320A1.420-12.20 (3) G.S(%) CMQ={1-[A1.624A1.745/1.33] } *100% (4) Ensaios de Coagulação/Floculação – Jar Test Os ensaios de coagulação/floculação foram realizados em equipamento Jar-Test marca Milan, modelo JT 102. Em cada ensaio, o coagulante avaliado foi adicionado a 1L de água sintética, que foi submetida à mistura rápida a 200 rpm por 2 min, e posterior mistura lenta a 40 rpm por 20 min. Logo após, o sistema foi desligado e deixado em repouso para sedimentação da mistura por um período de 20 min. Amostras do sobrenadante (2 cm abaixo da superfície) foram removidas cuidadosamente para avaliação físico-química e mensuração da eficiência de cada processo. As eficiências de remoção de cor e turbidez foram estimadas em termos percentuais, conforme as Equações 5 e 6, respectivamente. %Remoção Turbidez (T) = Tinicial-Tfinal/Tinicial*100 (5) %Remoção Cor (C)= Cinicial-Cfinal/Cinicial*100 (6)
Resultado e discussão
A síntese da CMQ mostrou-se eficaz na formação de um derivado de maior
solubilidade em meio aquoso. Os graus de desacetilação da QUI determinado
foi de 71% por titulação e 73% por FTIR. A CMQ, apresentou 56% de grau de
substituição por titulação e 61% por FT-IR. Desta forma é possível observar
a proximidade dos resultados obtidos pelas diferentes metodologias
analíticas empregadas.
A inserção dos novos grupamentos químicos foi promovida em mais de 50% dos
sítios reacionais iniciais da quitosana (G.S.CMQ 56,2-61,4%), constituidos
por átomos de hidrogênio presentes em hidroxilas e em grupos amino
primários, que foram substituídos com sucesso por grupos carboximetílicos,
promovendo um consequente aumento da massa final do produto e gerando um
rendimento de reação de 105,63%.
O cálculo do G.S. não diferencia as posições nas quais os grupos
carboximetílicos são inseridos, fazendo apenas mensuração quantitativa sobre
o teor total de hidrogênios substituídos por grupos -CH2COOH. Considera-se,
portanto, que o produto obtido é uma mistura de O-CMQ (substituição na
hidroxila) e N-CMQ (substituição no grupo amino). A síntese conduzida em
meio fortemente alcalino, conforme realizado neste trabalho, ativa as
hidroxilas presentes na quitosana e conduz à formação preferencial da O-CMQ
(BORSAGLI, 2015), preservando os grupos amino (-NH2), fundamentais para a
atividade coagulante do material.
Espectroscopia da região do infravermelho
Os espectros de infravermelho da QUI e CMQ são mostrados concomitantemente
na Figura 1. As principais alterações estudadas foram observadas na faixa de
1.000-2.000 cm-1. É possível perceber a presença de bandas típicas da
quitosana, situadas em 1.654 e 1.596 cm-1, correspondentes às deformações
simétricas e assimétricas, respectivamente, de amida I e II. A inserção dos
grupos carboximetílicos na QUI, notadamente na forma ácida, é evidenciada
pelo surgimento de uma nova banda de absorção em 1.745cm-1, associada à
formação de dímeros carboxílicos através de interações intermoleculares.
Percebe-se também que a banda de amida I em 1.654 cm-1, presente
inicialmente na QUI, se deslocou para 1.624 cm-1, devido às ligações de
hidrogênio estabelecidas entre os grupos amida e carboxila. A diminuição na
intensidade das bandas em 1.155 cm-1 (C-O-C) e 1.320 cm-1 (amida III) podem
estar associadas às modificações conformacionais e estruturais resultantes
das substituições dos hidrogênios hidroxílicos dos carbonos 6 e 3 da QUI por
grupos carboximetílicos (ABREU, 2008; SILVA, 2011; BORSAGLI, 2015). Silva
(2011) associou ainda a diminuição da intensidade da banda em 3.422 cm-1 à
substituição de hidrogênios hidroxílicos por grupos carboximetílicos.
Estudo da eficiência da remoção de cor e turbidez
A Figuras 2 mostra os resultados comparativos obtidos nos testes de
coagulação utilizando QUI, CMQ e sulfato de alumínio como agentes de remoção
de turbidez. Os biocoagulantes demostraram os melhores resultados, com
dosagens ótimas de 4 à 5 mg.L-1 para a QUI e de 6 à 7 mg.L-1 para a CMQ.
Para o Al2(SO4)3, rendimentos equivalentes só foram obtidos utilizando
dosagens maiores que 40 mg.L-1. Para a remoção de cor os resultados foram
similares, com remoção de cor de 99% usando dosagens de 4 a 5 mg/L para
QUI e de 6 a 7 mg/L para CMQ. O comportamento gráfico observado para cada
coagulante mostra que QUI e CMQ exibem resultados máximos de eficiência
operacional consumindo quantidades de 6 à 10 vezes menores do que aquelas
necessárias para o sulfato de alumínio, aliando alta eficiência e baixo
consumo de material. Sánchez-Martín, González-Velasco e Beltrán-Heredia
(2010) já relatavam a baixa eficiência operacional do sulfato de alumínio
(aplicado em dosagens de 15 mg.L-1) quando comparado a diversos outros
biocoagulantes, como aqueles baseados nas sementes da espécie Moringa
oleífera (Lam) e em taninos vegetais.
A maior eficiência dos biocoagulantes está associada à estrutura química e
aos mecanismos de ação de cada um deles. A dissolução inicial em meio ácido
permite a protonação dos grupos amino presentes ao longo das estruturas da
quitosana e carboximetilquitosana, tornando-os polieletrólitos catiônicos
capazes de neutralizar/reduzir as cargas superficiais das partículas em
suspensão (que comumente apresentam carga superficial negativa), permitindo
sua agregação, com consequente formação de flocos densos, que sedimentam
rapidamente. A formação de pontes intracadeias permite ainda a criação de
uma rede adsorvente que colabora para a remoção do particulado presente no
meio (RENAULT et al., 2009; LEE; ROBINSON; CHONG, 2014). A queda na
eficiência coagulante da QUI, observada a partir de concentrações de 8,0
mg.L-1, pode estar associada com o excesso de cargas positivas adicionadas
ao meio (-NH3+), que contribuem para a reestabilização do material em
suspensão. Para a CMQ, observa-se uma ampla faixa de concentrações com altos
índices de eficiência coagulante (3-10 mg.L-1); a reestabilização, resultado
da reversão de cargas superficiais do material em suspensão, só começa a
ocorrer a partir de dosagens de 11 mg.L-1, sendo possível utilizar dosagens
maiores/menores sem perdas significativas de eficiência.
Os resultados obtidos para QUI e CMQ mostram-se promissores, principalmente
ao compararmos praticidade de aplicação, segurança sanitária e eficiência
operacional de outros coagulantes de origem natural descritos na literatura.
Diaz et al. (1999) relataram o uso de extratos brutos das espécies Prosopis
juliflora (Swartz) DC e Cactus latifaria na remoção de turbidez de águas
sintéticas, obtendo remoções de 85% e 95%, respectivamente, utilizando
dosagens de 10 mg.L-1 de cada material. A cactácea Opuntia ficus indica (L.)
Mill foi avaliada por Zhang et al. (2006) na remoção de turbidez de águas
naturais, obtendo-se 94% de eficiência, com consumo de 50 mg.L-1 de material
pulverizado. Oladoja et al. (2017) realizam estudos coagulantes com os
extratos aquosos das sementes da espécie Margaritarea discoidea (Baill.)
G.L. Webster sobre águas brutas sintéticas, obtendo remoções de turbidez
acima de 90% em todas as dosagens avaliadas. Todavia, um inconveniente
observado na pesquisa foi o surgimento de coloração esverdeada na água
tratada, proporcional ao aumento da concentração do biocoagulante no meio.
Abidin et al. (2013) estudaram a eficiência coagulante do extrato das
sementes da espécie Jatropha curcas L. (pinhão manso) sobre águas residuais
sintéticas, obtendo rendimentos de 99,4% de remoção de turbidez com a
utilização de 120 mg.L-1. No entanto, este último biocoagulante apresenta a
desvantagem de apresentar compostos tóxicos em suas sementes (ésteres de
forbol e proteínas alergênicas) que demandam tratamento prévio do material.
As eficiências operacionais de QUI e CMQ assemelham-se àquelas observadas
para biocoagulantes a base de taninos vegetais disponíveis no mercado
(Tanfloc e Silvafloc), que embora eficientes (remoção de particulado maiores
que 99%), demandam diversas etapas de produção (via Reação de Mannich) até a
obtenção do produto final.
O desempenho operacional dos dois biocoagulantes avaliados na remoção de cor
e turbidez corroboram trabalhos anteriores, como aquele conduzido por
Altaher (2012), que desenvolveu estudos sobre a utilização de quitosana como
biocoagulante no pré-condicionamento de água do mar destinada à osmose
reversa, objetivando a remoção do excesso de sólidos em suspensão lixiviados
pelas chuvas. Os resultados mostraram eficiências de remoção de turbidez
superiores à 97% utilizando-se dosagens de 18 mg.L-1 do
biopolímero, contrastando fortemente com as elevadas concentrações de
sulfato de alumínio (1.200 mg.L-1) necessárias para alcançar resultados
operacionais equivalentes.
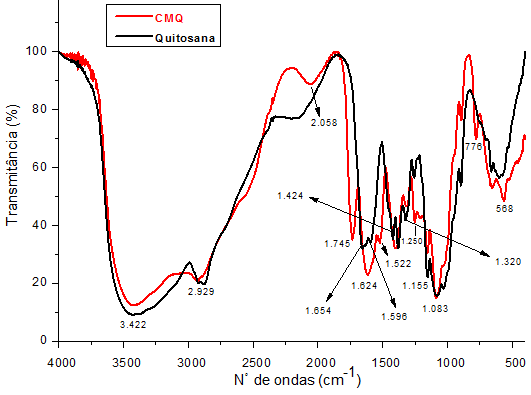
Espectros de infravermelho da quitosana (QUI) e carboximetilquitosana (CMQ)
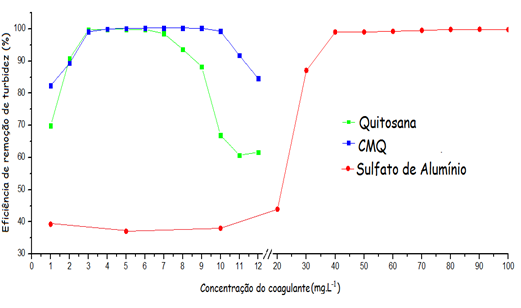
Eficiência de remoção de TURBIDEZ para quitosana, carboximetilquitosana e sulfato de alumínio
Conclusões
Os resultados do presente estudo mostraram as vantagens e desvantagens da aplicação de QUI e CMQ para tratamento de águas sintéticas altamente turvas, mostrando que a inserção de grupos carboximetílicos pode ser uma importante ferramenta para superar as limitações de aplicação ambiental da QUI, que envolvem a solubilidade restrita a meios ácidos, tipicamente com pH inferior a 6,5. A produção de um derivado solúvel em meios ácidos, básicos e neutros pode permitir o uso da CMQ para os mais variados tipos de tratamento de água e efluentes, pois percebeu-se uma manutenção da eficiência de coagulação numa ampla faixa de pH, com resultados de remoção de cor e turbidez superiores a 99%, utilizando-se dosagens bem menores, quando comparadas ao sulfato de alumínio e a outros biocoagulantes amplamente estudados. Turbidez e cor aparente residuais mínimas foram obtidas sem filtração da água; ao utilizar este processo, é possível, em teoria, diminuir ainda mais os valores finais destes parâmetros, adequando-os ao que preconizam os padrões de balneabilidade e potabilidade da água estabelecidos em diferentes nações. Quitosana e carboximetilquitosana são portanto biopolímeros promissores para o tratamento de águas, principalmente por valorizarem a utilização dos processos e princípios da química verde.
Agradecimentos
Agradecemos ao professor Men de Sá Moreira de Souza Filho, pesquisador da Embrapa Agroindústria Tropical e sua equipe pela colaboração. Ao Programa de Mestrado em Rec
Referências
ABIDIN, Zurina Z. et al. Optimisation of a method to extract the active coagulant agent from Jatropha curcas seeds for use in turbidity removal. Industrial Crops and Products, v. 41, p.319-323, jan. 2013. Elsevier BV. http://dx.doi.org/10.1016/j.indcrop.2012.05.003.
ABREU, Flávia Oliveira Monteiro da Silva. Síntese e caracterização de hidrogéis biodegradáveis à base de quitosana com morfologia controlada com potencial aplicação como carreadores de fármacos. 182 f. Tese (Doutorado) - Programa de Pós-graduação em Engenharia Minas, Metalúrgica e de Materiais, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2008.
ALTAHER, Hossam. The use of chitosan as a coagulant in the pre-treatment of turbid sea water. Journal of Hazardous Materials, v. 233-234, p.97-102, set. 2012. Elsevier BV. http://dx.doi.org/10.1016/j.jhazmat.2012.06.061.
ALVES, Keila dos Santos. Alquilação redutiva da quitosana a partir do glutaraldeído e 3-amino-1-propanol. 100 f. Dissertação (Mestrado) - Programa de Pós Graduação em Química, Universidade Federal do Rio Grande do Norte, Natal, 2008.
BANKS, W. A.; NIEHOFF, M.L.; DRAGO, D.; ZATTA, P. Aluminum complexing enhances amyloid β protein penetration of blood–brain barrier. Brain Res. 1116, 215–221, 2006.
BOLTO, B.; GREGORY, J. Organic polyelectrolytes in water treatment. Water Res. 41 (11), 2301-2324, 2007.
BORSAGLI, Fernanda Guerra Lima Medeiros. Preparação e caracterização de O-carboximetilquitosana (OCMQ) para aplicação como adsorvente de metais pesados. 181 f. Dissertação (Mestrado) - Programa de Pós-graduação em Engenharia Metalúrgica, Materiais e de Minas, Universidade Federal de Minas Gerais, Belo Horizonte, 2015.
BRUGNEROTTO, J. et al. An infrared investigation in relation with chitin and chitosan characterization. Polymer, v. 42, n. 8, p.3569-3580, abr. 2001. Elsevier BV. http://dx.doi.org/10.1016/s0032-3861(00)00713-8.
DIAZ, A. et al. A preliminary evaluation of turbidity removal by natural coagulants indigenous to Venezuela. Process Biochemistry, v. 35, n. 3-4, p.391-395, nov. 1999. Elsevier BV. http://dx.doi.org/10.1016/s0032-9592(99)00085-0.
HOWE, Kerry J. et al. Princípios de tratamento de água. São Paulo: Cengage Learning, 2016. 624 p.
HU, Ching-yao et al. Treatment of highly turbid water using chitosan and aluminum salts. Separation And Purification Technology, v. 104, p.322-326, fev. 2013. Elsevier BV. http://dx.doi.org/10.1016/j.seppur.2012.11.016.
KURITA, Keisuke. Chitin and Chitosan: Functional Biopolymers from Marine Crustaceans. Marine Biotechnology, v. 8, n. 3, p.203-226, 17 mar. 2006. Springer Nature. http://dx.doi.org/10.1007/s10126-005-0097-5.
LEE, Chai Siah.; ROBINSON, John.; CHONG, Mei Fong. A review on application of flocculants in wastewater treatment. Process Safety and Environmental Protection, v. 92, n. 6, p.489-508, nov. 2014. Elsevier BV. http://dx.doi.org/10.1016/j.psep.2014.04.010.
OLADOJA, N.a. et al. A new indigenous green option for turbidity removal from aqueous system. Separation and Purification Technology, v. 186, p.166-174, out. 2017. Elsevier BV. http://dx.doi.org/10.1016/j.seppur.2017.05.054.
POLIZZI, S.; PIRA, E.; FERRARA, M.; BUGIANI, M.; PAPALEO, A.; ALBERA, R.; PALMI, S. Neurotoxic effects of aluminium among foundry workers and Alzheimer’s disease. Neurotoxicology 23, 761–774, 2002.
RENAULT, F. et al. Chitosan for coagulation/flocculation processes – An eco-friendly approach. European Polymer Journal, v. 45, n. 5, p.1337-1348, maio 2009. Elsevier BV. http://dx.doi.org/10.1016/j.eurpolymj.2008.12.027.
RICHTER, Carlos A.; AZEVEDO NETO, José M. de. Tratamento de Água: Tecnologia atualizada. São Paulo: Blucher, 1991.
ROUSSY, J.; VAN VOOREN, M.; DEMPSEY, B.A.; GUIBAL, E. Influence of chitosan characteristics on the coagulation and the flocculation of bentonite suspensions. Water Res. 39 (14), 3247-3258, 2005.
SÁNCHEZ-MARTÍN, J.; GONZÁLEZ-VELASCO, M.; BELTRÁN-HEREDIA, J.. Surface water treatment with tannin-based coagulants from Quebracho (Schinopsis balansae). Chemical Engineering Journal, v. 165, n. 3, p.851-858, dez. 2010. Elsevier BV. http://dx.doi.org/10.1016/j.cej.2010.10.030.
SILVA, Daniella de Souza e. Estudos físico-químicos de O-carboximetilação de quitosana. 102 f. Dissertação (Mestrado) - Instituto de Química de São Carlos, Universidade de São Paulo, São Carlos, 2011.
SILVA, Diego Pereira da. Ação da Carboximetilquitosana isolada e em combinação com sais metálicos contra a formação de biofilmes por bactérias gram-positivas. 57 f. Dissertação (Mestrado) - Programa de Pós-graduação em Ciências Moleculares, Universidade Estadual de Goiás, Anápolis, 2015.
WALTON, J. R. Aluminum's involvement in the progression of Alzheimer's disease. J. Alzheimer's Dis. 35 (1), 7-43, 2013.
WANG, Ling Chong et al. Dissociation behaviors of carboxyl and amine groups on carboxymethyl-chitosan in aqueous system. Journal of Polymer Science Part B: Polymer Physics, v. 46, n. 14, p.1419-1429, 2008. Wiley. http://dx.doi.org/10.1002/polb.21475.
YANG, Ran et al. A review on chitosan-based flocculants and their applications in water treatment. Water Research, v. 95, p.59-89, maio 2016. Elsevier BV. http://dx.doi.org/10.1016/j.watres.2016.02.068.
ZHANG, Jingdong et al. A preliminary study on cactus as coagulant in water treatment. Process Biochemistry, v. 41, n. 3, p.730-733, mar. 2006. Elsevier BV. http://dx.doi.org/10.1016/j.procbio.2005.08.016.











