Adsorção de Paracetamol em Carbono Ativado
ISBN 978-85-85905-23-1
Área
Ambiental
Autores
de Sousa Cavalcante, M.R. (UFERSA) ; de Brito Soares, A.L. (UFERSA) ; de Sales Barbosa, A.R. (IFRN) ; Rodrigues de Oliveira, M. (UFERSA) ; Barbosa Rios, R. (UFERSA) ; Miranda da Silva, F.W. (UFERSA)
Resumo
Neste trabalho foi avaliado a adsorção de paracetamol a partir de soluções aquosas em um carbono ativado comercial. O efeito das variações das condições operacionais foi investigado, a saber: pH da solução e temperatura de adsorção. A determinação dos grupos funcionais e do potencial de carga zero (pHpcz) foram empregados na caracterização do adsorvente. Os experimentos revelaram que há maior concentração de ácidos fracos (fenólicos) na superfície e pHpcz= 7. No teste de pH a quantidade adsorvida a 30°C aumentou quando o pH aumentou de 2 até 8, porém diminuiu bastante em pH=12. As isotermas de adsorção foram feitas em pH 8 sob diferentes temperaturas (25, 30 e 40°C), obtendo melhor capacidade de adsorção a 25°C. As isotermas foram modeladas pelas equações de Langmuir e Freundlich.
Palavras chaves
Isotermas; Paracetamol; Carbono Ativado
Introdução
Nos últimos anos, a constante contaminação dos corpos hídricos por compostos bioativos como fármacos despertaram uma maior preocupação ambiental, uma vez que suas propriedades de interação com o sistema endócrino dos animais são capazes de gerar efeitos adversos mesmo em concentrações muito baixas (BERETTA et al., 2014, DAUGHTON et al., 2008). Há diversas fontes de emissões de fármacos no meio ambiente. Esses compostos não são completamente metabolizados pelo organismo e podem, portanto, entrar no meio ambiente através da excreção pelo sistema de esgoto (MOHD et al., 2015). Além disso, há o descarte inadequado da população e a geração de efluentes hospitalares (KERMIA et al., 2016; MARCELINO et al., 2017; PAPAGEORGIOUA et al., 2016). O principal problema do descarte indevido consiste no fato de que os processos convencionais de separação das estações de tratamento de efluentes e água não são projetados para remoção de fármacos, levando a descartes parciais no meio ambiente (PEREIRA et al., 2016; PRASSE et al., 2015). As classes de medicamentos que apresentam menor eficiência de remoção em estações de tratamento de efluentes (ETE) (entre 30 % e 50 %) são os analgésicos, antibióticos, meios de contraste, reguladores lipídicos, α-bloqueadores e diuréticos (DEBLONDE et al., 2011). Neste contexto, faz-se necessário avaliar a remoção de determinados medicamentos que estão presentes no dia a dia da população como é o caso do paracetamol que se destaca por ser um dos analgésicos mais liberados no meio ambiente (RIVERA-UTRILLA et al., 2013). Existem tecnologias de tratamento de efluentes que podem ser eficazes na remoção de fármacos, como: biorreatores com membranas (MBRs) (GÖBEL, 2007), processos oxidativos avançados (IKEHATA et al.,2006) e adsorção (RIVERA-UTRILLA et al., 2013). A adsorção em carbono ativado tem mostrado grande eficiência na remoção de diversos fármacos, além de ser um processo de baixo custo e fácil operação frente aos demais métodos (FERREIRA etal., 2015; RAO, 2015). Diante disso, o objetivo deste trabalho foi avaliar a capacidade de adsorção do paracetamol em um carbono ativado comercial avaliando os efeitos do pH da solução e temperatura de adsorção.
Material e métodos
MATERIAL Adsorvato O paracetamol é um medicamento com atividade farmacocinética utilizada por suas propriedades analgésicas e antipiréticas clinicamente significativas (TIMBRELL, 2000). Por ser vendido livremente, sem a necessidade de prescrição médica, é um dos fármacos mais consumidos e descartados no ambiente. Sua molécula possui vários grupos funcionais: grupo carbonila (C=O) e hidroxila (O-H), uma estrutura aromática (anel benzeno) e uma nitrila (– CN). O medicamento foi utilizado na forma pulverizada com pureza de 100% (FAGRON). As soluções aquosas foram preparadas utilizando água deionizada (Milli-Q) ajustadas nos pH’s estudados. Adsorvente O adsorvente utilizado foi o carbono ativado NORIT GAC 830W produzido pela empresa Norit (Holanda). As amostras na forma granulada foram submetidas à caracterização e a ensaios de adsorção em batelada conforme descrito nas seções seguintes. MÉTODOS Caraterização do adsorvente O adsorvente foi caracterizado pela determinação de grupos superficiais e do potencial de carga zero (pHpcz). Em todos os ensaios de caracterização, o adsorvente foi previamente ativado a 120°C durante 12h e deixado resfriar sob vácuo até temperatura ambiente. Os experimentos foram realizados em duplicata. A quantificação dos grupos funcionais presentes na superfície do carbono, tais como os grupos carboxílicos, lactônicos, fenólicos e básicos foi feita utilizando a metodologia proposta por Boehm (2001), a qual está descrita em Barbosa (2017). Para determinação do potencial de carga zero foi empregado o "método drift" (método potenciométrico, ou da deriva) (PRAHAS et al., 2008 ). A metodologia está descrita em Barbosa (2017). Teste de pH Este experimento foi usado para determinar qual o meio que concede maior quantidade adsorvida de paracetamol. Os pH’s avaliados foram 2, 5, 8 e 12. Foram preparadas soluções aquosas de paracetamol com concentração de 100 mg/L. Foi utilizada água milli-Q ajustada no pH desejado para o preparo das soluções. O ensaio consiste em colocar em contato uma alíquota de 20 mL de solução com 10 mg de carbono ativado em erlenmeyers de 50 mL, submetidos a agitação de 160 RPM e temperatura controlada de 30 °C. Finalmente, após um período de 180 minutos é medida a absorbância e assim calcula-se a quantidade removida de paracetamol. Os ensaios foram feitos em duplicata. Isoterma de Adsorção Para determinar as isotermas de adsorção, foram pesadas, em duplicata, 0,01 g de adsorvente e colocados em contato com 20 mL do analito em diferentes concentrações (20, 30, 40, 50, 75, 100, 125, 150, 175 e 200 mg de paracetamol/L de água) ajustadas no pH ideal (pH=8), que foi obtido na etapa de teste de pH. As amostras foram colocadas sob agitação com velocidade de agitação de 160 RPM e temperaturas de 25, 30 e 40°C. A concentração da solução em equilíbrio foi medida após um período de 840 minutos de contato, baseando-se no tempo de equilíbrio obtido através de ensaios cinéticos.
Resultado e discussão
Caracterização do Adsorvente
Análise de Grupos Superficiais
Os resultados da quantificação dos grupos na superfície mostraram que a
superfície do carbono se caracteriza pela presença de grupos básicos (0,145
meq/g), por grupos ácidos fortes como os carboxílicos (0,130 meq/g), e
principalmente, por grupos fenólicos (0,400 meq/g). Os ácidos fenólicos são
caracterizados por serem muito fracos e, portanto, sofrem desprotonação
apenas em pH maiores do que 10. Os grupos carboxílicos e fenólicos tornam o
meio hidrofílico e ácido, no qual tendem a diminuir o valor do pH e do ponto
de
carga zero (MARSH et al.,2006).
Potencial de Carga Zero (pHpcz)
O ponto de carga zero é aquele em que o valor de carga líquida do adsorvente
está nulo. A importância desta variável na adsorção está ligada à oposição
das cargas. As cargas do adsorvato e do adsorvente devem ser opostas para
que
haja uma maior interação eletrostática entre ambos, pois, se as estas forem
iguais, o processo de adsorção será prejudicado, uma vez que haverá repulsão
eletrostática (TOLEDO et al., 2005). A determinação foi feita graficamente e
foi obtido pHpcz=7,0.
Teste de pH
A determinação do pH ideal é um passo muito importante para estabelecer as
condições operacionais de um processo de separação por adsorção. A
quantidade adsorvida de paracetamol após um período de 180 minutos em
diferentes pH's foram: pH 2 (58,70 mg/g), pH 5 (54,70 mg/g), pH 8,0 (64,86
mg/g) e pH 11,0 (16,69 mg/g).
Observa-se que o pH 8 é o melhor, pois obteve-se a maior quantidade removida
de paracetamol. Em pH’s 2 e 5, as quantidades adsorvidas foram próximas.
Por
sua vez, em pH 12, há uma drástica redução da quantidade removida. Este
resultado pode ser explicado pela forma molecular do paracetamol. A molécula
neutra ocorre no intervalo de pH entre 2,0 e 10,0. Acima deste limite, a
molécula de paracetamol se apresenta na forma aniônica devido à presença da
carga negativa nos grupos fenólicos havendo, portanto, repulsão com os
grupos
fenólicos presentes na superfície do adsorvente (FERREIRA et al., 2015).
Isoterma
As isotermas de adsorção de paracetamol em carbono ativado Norit 830 W foi
obtida sob as seguintes condições: pH=8 e tempo de equilíbrio de 840
minutos, duas horas a mais do que tempo de equilíbrio obtido em ensaios
prévios
de cinética (ver Figuras 1 e 2). Em relação ao efeito da temperatura sobre a
quantidade adsorvida, não se observa um comportamento bem definido tal como
o
efeito do pH. Em baixas concentrações de equilíbrio (~40 mg/L), a maior
capacidade foi obtida a 30°C. Acima da concentração de equilíbrio de 60
mg/L,
maiores capacidades de adsorção foram obtidas para a isoterma a 25°C. Tais
resultados foram aos reportados em FERREIRA et al. (2015).
A Figura 2 mostra que a capacidade de adsorção é similar a obtida no
trabalho
dos autores. Ainda na Figura 1, observa-se os ajustes das equações de
Langmuir
e de Freundlich foram usadas na modelagem do equilíbrio de adsorção. O
modelo
de Langmuir foi o que melhor se ajustou aos dados experimentais na
temperatura
de 30°C, já em 25°C e 40°C o modelo de Freundlich se ajustou melhor, de
acordo
com o coeficiente de correlação (R²) demonstrado na Tabela 1. O parâmetro n,
calculado no modelo de Freundlich, indica como os sítios ativos estão
distribuídos na superfície do adsorvente. Segundo Giles et al. (1960) para
os
valores de n > 1, tem-se que o processo de adsorção é favorável, e isso foi
encontrado para todos os experimentos realizados.
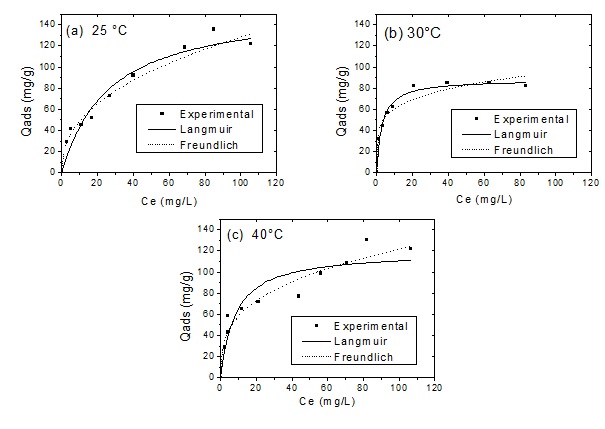
Figura 1. Isoterma de adsorção do paracetamol e ajustes dos modelos: (a) 25°C, (b) 30 °C e (c) 40°C. (Autoria própria, 2018)
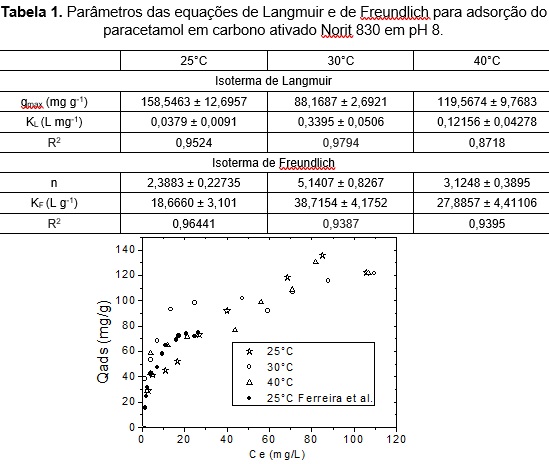
Figura 2. Isotermas de adsorção do paracetamol em diferentes temperaturas.
Conclusões
As potencialidades do carbono ativado para a remoção de paracetamol foram investigadas. Os experimentos mostraram que o efeito do pH foi significativo para adsorção do fármaco, na qual o pH 8 possibilitou uma maior capacidade de adsorção. O tempo de contato necessário para atingir o equilíbrio nas condições testadas foi de 720 minutos (12h) no pH 8. Na avaliação cinética, o modelo que melhor descreveu a adsorção do paracetamol no carbono ativado foi o modelo de pseudo-segunda ordem, sendo encontrado um coeficiente de correlação (R²) de 0,99154 no pH ideal. Na investigação do equilíbrio de adsorção, a isoterma na temperatura de 25°C foi a que teve uma quantidade adsorvida maior, indicando que nas condições dadas é a temperatura mais ideal entre as comparadas para os métodos de adsorção. Tendo em vista os dados apresentados neste estudo, pode-se sugerir que a adsorção é uma tecnologia eficaz na remoção do paracetamol em carbono ativado.
Agradecimentos
Referências
APEEL, C.; MA, L. Q.; RHUEL, R. D. Point of zero charge determination in soils and minerals via traditional methods and detection of electroacoustic mobility. Geoderma, v. 113, p. 77-93, abr. 2003.
BARBOSA, A. R. S. de S. Caracterização e aplicação na remoção de cromo hexavalente de um bioadsorvente obtido de endocarpo de spondias purpurea l. 130 f. Dissertação (Mestrado) – Universidade Federal Rural do Semi-Árido, Mossoró-RN, 2017.
BERETTA, M. et al. Occurrence of pharmaceutical and personal care products (ppcps) in marine sediments in the todos os santos bay and the north coast of salvador, bahia, brazil. Journal of soils and sediments, 2014. v. 14, n. 7, p. 1278–1286.
BOEHM, H. P. Surface oxides on carbon and their analysis: a critical assessment. Carbon, v. 40, n. 2, p. 145–149, fev. 2002.
DAUGHTON, C.; TERNES, T. Special report: pharmaceuticals and personal care products in the enviornment: agents of subtle change? Environmental health perspectives, 2008. v. 107, Suppl.
DEBLONDE, T.; COSSU-LEGUILLE, C.; HARTEMANN, P. Int. J. Hyg. Environ. Health, v. 214, n. 6, p. 442–448, 2011.
FERREIRA, R. C. et al. Effect of solution pH on the removal of paracetamol by activated carbon of dende coconut mesocarp. Chemical and Biochemical Engineering Quarterly, v. 29, n. 1, p. 47-53, 2015.
GILES, C.H.MACEWANS, T.H; NAKHWA, N; SMITH, D. J. Chem. Soc, p. 3973-3993, 1960.
GÖBEL, Anke et al. Fate of sulfonamides, macrolides, and trimethoprim in different wastewater treatment technologies. Science of the Total Environment, v. 372, n. 2-3, p. 361-371, 2007.
HO, Y. S.; MCKAY, G. A kinetic study of dye sorption by biosorbent waste product pith. Resources, Conservation and Recycling, v. 25, p. 171-193, 1 mar. 1999.
IKEHATA K., NAGHASHKAR N.J., EL-DIN M.G. Degradation of aqueous pharmaceuticals by ozonation and advanced oxidation processes: a review. Ozone: Sci. Technol., v.28, p.353-414, 2006.
KERMIA, A. E. B.; FOUIAL-DJEBBAR, D.; TRARI, M. C. R. Chim., v. 19, n. 8, p. 963–970, 2016.
LAGERGREN, S. Zur theorie der sogenannten adsorption gelõster stoffe, Kungliga Svenska Vetenskapsakademiens. Handlingar, v. 24, p. 1-39, 1898.
LUNA, F.M.T. et al. Adsorption of naphthalene and pyrene from isooctane solutions on comercial activated carbons. Adsorption (2011) 17:937–947.
MARCELINO, R. B. P.; LEÃO, M. M. D.; LAGO, R. M.; AMORIM, C.C. Multistage ozone and biological treatment system for real wastewater containing antibiotics. Journal of Environmental Management, v. 195, p. 110-116, 2017.
MARSH, H., REINOSO, F. R., Activated Carbon. Elsevier, London, 2006.
MOHD, N.; SUDIRMAN, M. F. A. E.; DRAMAN, S. F. S. ARPN J. Eng. Appl. Sci., v. 10, 2015.
PAPAGEORGIOUA, M.; KOSMAB, C.; LAMBROPOULOU, D. Sci. Total Environ., v. 543, p. 547-569, 2016.
PEREIRA, C. D.; MARANHO, L. A.; CORTEZ, F. S.; PUSCEDDU, F. H.; SANTOS, A. R.; RIBEIRO, D. A.; CESAR, A.; GUIMARÃES, L. L. Sci. Total Environ., v. 548-549, p. 148-154, 2016.
PRAHAS, D.; KARTIKA, Y.; INDRASWATI, N.; ISMADJI, S. Activated carbon from jackfruit peel waste by H3PO4 chemical activation: Pore structure and surface chemistry characterization. Chemical Engineering Journal, v. 140, p. 32 - 42, 2008.
PRASSE, C. et al. Water Res., v. 87, p. 237–270, 2015.
RANDLES, D.; KAM, J. W. Y.; HEINE, S. J.; INZLICHT, M.; HANDY, T. C. Acetaminophen attenuates error evaluation in cortex. Social Cognitive and Affective Neuroscience, v. 11, n. 6, p. 899–906, 2016.
RAO, A.N., Journal of Chemical and Pharmaceutical Research, v. 6 (12), p. 570-574, 2014.
RIVERA-UTRILLA, José et al. Pharmaceuticals as emerging contaminants and their removal from water. A review. Chemosphere, v. 93, n. 7, p. 1268-1287, 2013.
TIMBRELL, J. Principles of biochemical toxicology. 3. ed. [S.l.]: Taylor & Francis, 2000.
TOLEDO, B. I. et al. Bisphenol a removal from water by activated carbon, Effects of carbon characteristics and solution chemistry. Environmental Science Technology, v. 39, p. 6246–6250, 9 jul. 2005.











