ÁREA: Química Orgânica
TÍTULO: PIRAZOLO[1,5-A]PIRIMIDINAS: SíNTESE, BROMAçãO E ATIVIDADE ANTIMICROBIANA
AUTORES: MARTINS, M.A.P. – UFSM
SCAPIN, E. – UFSM
COELHO, H.S. – UFSM
FRIZZO, C.P. – UFSM
VARGAS, P.S. – UFSM
ZANATTA, N. – UFSM
BONACORSO, H.G. – UFSM
RESUMO: Este trabalho apresenta a síntese de 3-bromo-2-metilpirazolo[1,5-a]pirimidinas a partir da reação de 2-metilpirazolo[1,5-a]pirimidinas com N-bromosuccinimida em THF. A síntese das 2-metilpirazolo[1,5-a]pirimidinas foi realizada a partir da reação de ciclocondensação do 5-metil-3-aminopirazol com 4-alcoxi- ou 4-dimetilamino-3-alquen-2-onas. Considerando o potencial farmacológico apresentado pelas pirazolo[1,5-a]pirimidinas, foi avaliado o seu perfil de atividade antimicrobiana. Os microrganismos utilizados nos ensaios para determinação da concentração inibitória mínima provieram de cepas catalogadas pela American Type Culture Collection, constituídas de bactérias gram-positivos e gram-negativos. As pirazolopirimidinas avaliadas apresentaram moderada atividade antibacteriana.
PALAVRAS CHAVES: pirazolopirimidinas, bromação, antibacteriana
INTRODUÇÃO: Heterociclos nitrogenados como piridinas6, pirimidinas7, pirazóis2 e pirazolopirimidinas8 são alvo de intensas pesquisas em busca do aumento pelo potencial biológico dos mesmos. Dentre muitos destacam-se o celecoxib (Celebra)5, potente antiinflamatório que atua como inibidor seletivo da enzima prostaglandina endoperóxido sintase-2; o zaleplon (Sonata®)1, agente hipnótico não-benzodiazepinico utilizado no tratamento da insônia; o sildenafil (Viagra), usado contra a impotência masculina. Os compostos desta classe têm ainda atraído interesse farmacêutico devido a atividade antitripanossômica3 e atividade esquistossômica4. Assim, considerando o grande potencial farmacológico apresentado pelas pirazolo[1,5-a]pirimidinas, os objetivos deste trabalho são realizar o estudo das reações de ciclocondensação do tipo [NCN] + [CCC] entre o 3-metil-5-aminopirazol e 1,1,1-tricloro-4-alcoxi-3-alquen-2-onas e das reações de ciclocondensação do tipo [NCN] + [CCC] entre o 3-metil-5-aminopirazol e -dimetilaminovinil cetonas (Esquema 1). E, realizar a reação de bromação das pirazolo[1,5-a]pirimidinas sintetizadas com a finalidade de avaliar a possível atividade antibacteriana.
MATERIAL E MÉTODOS: Uma solução de aminopirazol (1.0 mmol) em ácido acético (5mL) foi adicionada, sob agitação, ao precursor 1,1,1-tricloro-3-alquen-2-onas (ou β-dimetilaminovinilcetonas) (1.0 mmol) em ácido acético (5mL). A mistura foi agitada por 16 horas. Após o tempo reacional, o produto foi isolado com clorofórmio (3 10 mL), lavado com água destilada (3 10 ml), e seco com sulfato de magnésio. O solvente foi removido no rotaevaporador e o sólido resultante foi purificado por recristalização em hexano. As reações de bromações foram feitas pela mistura das pirazolo[1,5-a]pirimidinas (1 mmol), N-bromosuccinimida (1 mmol) e THF (5 mL). A solução foi agitada por 20 horas sob temperatura de refluxo. Após o tempo reacional, a solução foi extraída com clorofórmio (3 10 mL), lavada com água destilada (3 10 ml), e seca com sulfato de magnésio. O solvente foi removido no evaporador rotatório e o sólido resultante foi purificado por recristalização em hexano. Todos os compostos sintetizados foram obtidos com pureza satisfatória e identificados através de espectroscopia de RMN de 1H, 13C, HMQC, HMBC, CG-MS, Difração de Raio-X e Análise elementar.
RESULTADOS E DISCUSSÃO: Os resultados mostram que foi possível obter uma série de dez compostos em bons rendimentos (Esquema 1). A regioquímica da formação as 2-metil-7-triclorometil-5-alquilpirazolo[1,5-a]pirimidinas (3a-c) e 2-metil-7-aril-5-alquilpirazolo[1,5-a]pirimidina (3d-j) foi confirmada através de espectroscopia de RMN de 1H, 13C, HMQC, HMBC, CG-MS e Difração de Raio-X. A atividade antimicrobiana foi avaliada baseada na concentração inibitória mínima (CIM) de acordo com os procedimentos para bactérias conforme a NCCLS M7-A4. Desta forma, a atividade antimicrobiana in vitro para as pirazolo[1,5-a]pirimidinas bromadas e não bromadas foi avaliada frente a uma série de microrganismos patogênicos incluindo bactérias gram-positivas e gram-negativas, de acordo com o método de microdiluição em caldo. Na Tabela 1 estão reportadas as concentrações das pirazolo[1,5-a]pirimidinas necessárias para inibir o crescimento dos diferentes microrganismos utilizados nos ensaios. Os compostos evidenciaram moderada atividade antibacteriana. Após análise dos resultados verificou-se que apresentam apenas atividade bacteriostática. Os compostos 4d e 4f apresentaram-se ativos frente a bactérias gram-positiva.
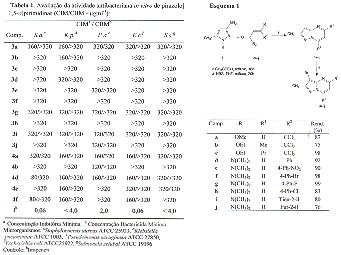
CONCLUSÕES: As reações entre o 3-metil-5-aminopirazol com 1,1,1-tricloro-4-alcoxi-3-alquen-2-onas e β-dimetilaminovinilcetonas apresentaram-se satisfatórias, obtendo-se as pirazolo[1,5-a]pirimidinas com altos rendimentos e pureza considerável. A bromação dos compostos 3 a-j utilizando N-bromosuccinimida ocorreu na posição 3 do anel pirazolínico com bons rendimentos. Os compostos apresentaram moderada atividade antibacteriana em relação aos não bromados, demonstrando a importância deste grupo para o aparecimento da atividade antibacteriana nestes compostos.
AGRADECIMENTOS:Os autores agradecem ao CNPq/PRONEX, FAPERGS pelo apoio financeiro. Os autores também agradecem as bolsas concedidas pelo CNPq, CAPES e FATEC.
REFERÊNCIAS BIBLIOGRÁFICA:1. (a) GEORGE, C. F. P. The Lancet 2001, 357, 1623. (b) WEITZEL, K. W.; WICKMAN, J. M.; AUGUSTIN, S. G.; STROM, J. G. Clinical Therapeutics 2000, 22, 1254.
2. (a) MARTINS, M. A. P.; PEREIRA, C. M. P.; BECK, P.; MACHADO, P.; MOURA, S.; TEIXEIRA, M. V.; BONACORSO, H. G.; ZANATTA, N. Tetrahedron Lett. 2003, 44, 6669.
3. SENGA, K.; NOVINSON, T.; WILSON, H. R. J. Med Chem. 1981, 24, 610.
4. SUZUKI, M.; IWASAKI, H.; FUJIKAWA, Y.; SAKASHITA, M.; KITAHARA, M.; SAKODA, R. Bioorg. Med Chem. 2001, 11, 1285.
5. PENNING, T. D. ET ALL. J. Med. Chem. 1997, 40, 1347.
6. ZANATTA, N.; BARICHELLO, R.; BONACORSO, H. G; MARTINS, M. A. P Synthesis 1999, 765.
7. (A) ZANATTA, N.; ROSA, L. S.; LORO, E.; BONACORSO, H. G; MARTINS, M. A. P. J Fluorine Chem, 2001, 107, 149. (b) ZANATTA, N.; CORTELINI, M. F. M.; CARPES, M. J. S.; BONACORSO, H. G; MARTINS, M. A. P. J. Heterocyclic Chem. 1997, 34, 509.
8. WILLIAMSON, D. S.; PARRAT, M. J.; BOWER, J. F.; MOORE, J. D.; RICHARDSON, C. M.; DOKURNO, P.; CANSFIELD, A. D.; FRANCIS, G. L.; HEBDON, R. J.; HOWES, R.; JACKSON, P. S.; LOCKIE, A. M.; MURRAY, J. B.; NUNNS, C. L.; POWLES, J.; ROBERTSON, A.; SURGENOR, A. E.; TORRANCE, C. J. Bioorg. and Med. Chem. Lett., 2005, 15, 863.
