ÁREA: Química Orgânica
TÍTULO: ESTUDO QUÍMICO DAS FOLHAS DE UMA ESPÉCIE DE LAURACEAE QUE OCORRE NO MUNICÍPIO DE JAPORÃ-MATO GROSSO DO SUL
AUTORES: PARREIRA M. W. F.1; SANTOS, N. M. S.1; RODRIGUES, F. A.1 , SILVA A. F. G. 1, MINGUZZI S.1
UNIVERSIDADE ESTADUAL DE MATO GROSSO DO SUL - UNIDADE UNIVERSITáRIA DE NAVIRAí 1 (ANA.FRANCISCA@IG.COM.BR)
RESUMO: Este trabalho descreve o estudo químico das folhas de Cinnamomum sp. (Lauraceae), coletada em Mato Grosso do Sul, analisando-se também sua atividade antioxidante. Foi selecionada para estudo a fase hexânica, obtida da partição do extrato etanólico das folhas, da qual foi isolada, através de técnicas cromatográficas a lignana (+) Sesamina. As determinações estruturais foram efetuadas com base em dados espectroscópicos de RMN 1H e 13C (DEPT 135º) e a partir de informações obtidas dos espectros e por comparação dos dados espectrais obtidos com os existentes na literatura. As lignanas são substâncias que apresentam atividade biológica antitumoral, antiviral, antifúngica, antimicrobiana e antiinflamatória, entre outras e são comuns em plantas da família Lauraceae.
PALAVRAS CHAVES: cinnamomum, lignana, sesamina.
INTRODUÇÃO: A família Lauraceae ness é constituída por mais de 50 gêneros e cerca de 2500 espécies (CHRISTOPHEL, 1996). A grande maioria deste grupo de vegetais é constituída por plantas lenhosas e arbóreas (CORREA, 1994) e os gêneros principais são: Aniba, cinnamomum, Ocotea, Nectandra e Persea. As lauráceas destacam-se economicamente: no comércio do abacate (Persea), na importação da canela (algumas espécies dessa família são chamadas de canela), e também na produção de madeira de qualidade, como as dos gêneros Mezilaurus e Phoebe (AGARES, 1994). Na medicina natural, desempenham diferentes funções devido à presença de metabólitos secundários tais como: neolignanas, lignanas, alcalóides do tipo aporfínico e benzilisoquilínico, monoterpenos e sesquiterpenos (CARVALHO, 1987). Algumas espécies ainda são ricas em óleo essencial (SCORA, 2001). O presente projeto tem como objetivo realizar o estudo químico das folhas de um espécime de Cinnamomum sp. que ocorre em Mato Grosso do Sul, monitorado por ensaio de atividade antioxidante. Esta espécie é conhecida como canela e muito utilizada como medicamento pela comunidade local e pelos índios da aldeia Porto Lindo localizada no município.
MATERIAL E MÉTODOS: O material vegetal foi coletado, no município de Japorã-MS. As folhas (1600 g) foram submetidas à secagem ao ar, moídas e extraídas exaustivamente com etanol, a frio.
O extrato resultante foi concentrado no rota vapor obtendo-se o extrato etanólico bruto. O extrato foi submetido à partição com hexano. Desta forma foram obtidos após a evaporação do solvente 19,80 g de extrato hexânico. O extrato hexânico foi submetido à cromatografia em coluna, utilizando-se sílica gel 230 MESH. O sistema foi eluído com solventes em ordem crescente de polaridade, iniciando-se com hexano e aumentando-se a polaridade para acetato de etila/metanol e terminando com metanol. Das 15 frações coletadas, selecionou-se para estudo após cromatografia em camada delgada (CCD), quatro frações eluidas com hexano, que foram enviadas para análise por RMN. A partir do extrato bruto foi obtida por cristalização uma lignana.Para a detecção de atividade antioxidante foi feita a CCD do extrato hexânico em placa de sílica gel realizando-se a separação com solvente apropriado. Após a secagem, a placa foi vaporizada com uma solução de beta-caroteno (0,05% em diclorometano) [Pratt & Miller, 1984].
RESULTADOS E DISCUSSÃO: A determinação estrutural da (+) sesamina obtida da fase hexânica foi determinada por comparação de dados da literatura (Rao, 1978). O espectro de RMN 1H apresentou um singleto em 5,69 ppm referente ao grupo dioximetileno (CH2) e sinais múltiplos para os hidrogênios de um sistema tetrahidrofurano em 3,86-3,97 ppm., foram observados também os hidrogênios aromáticos a 6,50-6,61 ppm. Os sinais dos carbonos nos espectros de RMN 13C e DEPT 135°, permitiram confirmar a presença de dois anéis aromáticos na substância com substituição do tipo piperonila [Dados em ppm: 106,3; 107,7; 118,9 (CH); 134,7; 146,7; 147,6 e 100,7 (OCH2O)] além destes sinais observa-se um grupamento tetraidrofurânico com carbono metilênico a 71,2 ppm e dois carbonos metínicos a 53,9 e 85,3 ppm). Os valores atribuídos no RMN13C para C-1/C-1’, C-7/C-7’, C-8/C-8’ e C-9/C-9’confirmaram a sua estereoquímica (ANEXO 1). A definição da forma isomêrica pôde ser feita com base no valor de deslocamento químico de C-7/C-7’ (AGRAWAL, 1985). O teste qualitativo de atividade antioxidante do extrato hexânico foi positivo. KATO et alli descrevem uma potente propriedade antioxidante para a (+) Sesamina.
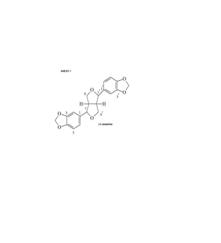
CONCLUSÕES: O estudo químico da fase hexânica das folhas de Cinnamomum sp. resultou na obtenção de uma lignana, identificada como (+) Sesamina. O teste para detecção de atividade antioxidante realizado com esta fase foi positivo. Estudos já realizados constataram que as lignanas são substâncias que apresentam atividade biológica antitumoral, antiviral, antifúgica, antimicrobiana e antiinflamatória, entre outras e são comuns em plantas da família Lauraceae (DONALD, 1984; LEWIS, 1995).
AGRADECIMENTOS:UEMS; Departamento de Química/UFMS.
REFERÊNCIAS BIBLIOGRÁFICA:AGARES, F. V., PEREIRA, C., RIZZINI, C. M. Botânica: Taxonomia. Morfologia e reprodução das angiospermae. 2ª ed. Rio de Janeiro, Âmbito Cultural, 1994, 256p.
AGRAWAL, P. K.; THAKUR, R. S. (1985) 13C NMR Spectroscopy of Lignan and Neolignan derivatives. Magn. Reson. Chem. 23, 389-418.
CHRISTOPHEL, D. C.; ROWETT, A. I. (1996) The use of cuticular featura in the taxonomy of the Lauraceae. Ann. Missouri Bot. Gard. 83, 419-432.
CORREA, M. P. Dicionário de plantas úteis do Brasil e das exóticas cultivadas. Rio de Janeiro, Imprensa Nacional, v. 1-6, 1984.
DE CARVALHO, M. G., YOSHIDA, M., GOTTLIEB, O. R. (1987) The chemistry of brasilian Lauraceae. 79. Neolignans from Nectandra puberula. Phytochemistry 26 (1), 269-272.
DONALD MACRAE, W.; NEIL TOWERS, G. H. (1984) Biological activities of lignans. Phytochemistry 23, 1207-1220.
KATO, M. J.; CHU, A.; DAVIN, L. B.; LEWIS, N. G. (1998) Bisynthesis of antioxidant lignans in Sesamum indicum seeds. Phytochemistry 47, 583-591.
LEWIS, N. G.; KATO, M. J.; LOPES, N.; DAVIN, L. B. (1995). Lignan: Diversity, Biosynthesis and Function. In: Chemistry of the Amazon. 1ª ed. Washinton DC, American Chemical Society, v. 1, 135-167p.
PRATT, D. E.; MILLER, E. E. J. (1984) A flavonoid antioxidant in Spanish peanuts. J.Am. Oil Chem. Soc. 61, 1064-1068.
SCORA, R. W., SCORA, P. E. (2001) “Essential leaf oil of Persea subgenus Eriodaphe and colsely realated Perseoid genera”. Journal of essential oil Research 13 (1), 37-42.
RAO, C. B. S. (1978) The Chemistry of lignans. Andhra Unicersity Press, 254-259.
