ÁREA: Bioquímica e Biotecnologia
TÍTULO: BIORREATOR DE INVERTASE IMOBILIZADA PARA PRODUçãO DE AçúCAR INVERTIDO
AUTORES: CADENA, P.G.1; JERÔNIMO, R.A.S.1; SILVA, R.A.1,2;
SILVA, V.L.3; LIMA FILHO, J.L.1,2; PIMENTEL, M.C.B.1,2
1LABORATóRIO DE IMUNOPATOLOGIA KEIZO ASAMI LIKA/UFPE; 2DEPARTAMENTO DE BIOQUíMICA/UFPE; 3DEPARTAMENTO DE ENGENHARIA QUíMICA/UFPE; (PABYTON@YAHOO.COM.BR)
RESUMO: O presente trabalho teve como objetivo avaliar a atividade da invertase imobilizada em poliuretano (PU) em um biorreator de leito fixo. A enzima foi ligada covalentemente ao suporte (PU) tratado com HCl, polietilenoimina e Glutaraldeído. O biorreator com volume de trabalho de 4,6 mL, foi testado, em solução de sacarose, em fluxo ascendente e descendente, velocidades de fluxos (0,03-0,48 L/h), e estabilidade operacional por 30 horas. O fluxo ascendente foi mais eficiente com taxa de conversão de 20,1% que o descendente (7,24%). Foi observada uma baixa transferência de massa em baixas velocidades (0,03 L/h) diminuindo a taxa de conversão (20,3%), enquanto numa maior velocidade (0,48 L/h), o efeito foi minimizado (56,9%). O biorreator perdeu 13,54% de sua atividade após 30h em operação.
PALAVRAS CHAVES: invertase, poliuretano, biorreator
INTRODUÇÃO: A invertase (β-D-frutofuranidase E.C. 3.2.1.26) catalisa a hidrólise da sacarose em α-D-glicose e β-D-frutose (açúcar invertido) tem sido imobilizada em diferentes suportes insolúveis em água (CHEN et al, 2000 e AKGOL et al, 2001). O xarope de açúcar invertido é mais denso comparado com o de sacarose, minimizando a cristalização e a contaminação microbiológica, além de possuir 20% a mais de doçura (GRATÃO et al, 2004).
A imobilização de enzimas apresenta vantagens, como a possibilidade de reusos em biorreatores (DANISMAN et al, 2004) Os reatores de leito fixo funcionam por contato facilitando as reações com enzimas imobilizadas (LEVENSPIEL, 2000; BORZANI et al, 2001). O Poliuretano (PU) é um polímero tridimensional (ROZMAN et al, 2002) formado por reação de condensação de poli-hidroxi (polióis) com isocianatos (LEFEBVRE et al, 2005), largamente utilizado pela indústria como espumas, adesivos, isolantes térmicos (ROZMAN et al, 2002). O objetivo deste trabalho foi avaliar a atividade do derivado imobilizado (PU-invertase) em biorreator de leito fixo e determinar os parâmetros ótimos para produção de xarope rico em açúcar invertido.
MATERIAL E MÉTODOS: Amostras de espuma de poliuretano (PU) comercial, pesadas, foram tratadas com a polietilenoimina a 10% (v/v) em tampão citrato de sódio 100 mM pH 5,0, a 37oC por 2 horas, com HCl 3 M durante 6 h a 25°C (ANITA et al, 1997). Seguido pelo tratamento com glutaraldeído 2,5% (v/v) a 4oC por 2 h. O PU tratado foi incubado em solução de invertase (NOVO) a 1 mg de pó/mL, preparada em tampão citrato sob agitação suave por 4 h a 4°C e em seguida lavados com NaCl 1M e solução tampão.
Um biorreator vertical foi construído com uma seringa de plástico (8,5 cm de altura e 1,4 cm de diâmetro interno) com telas de nylon nas extremidades, conectado a uma bomba peristáltica por tubos de silicone. A coluna foi carregada com 2g do derivado imobilizado (130U de atividade invertase). O volume de trabalho foi de 4,6 mL e em todos os experimentos foi utilizada solução de sacarose 10% (p/v) em tampão citrato de sódio 100 mM, pH 5,0 a 20°C sendo seu teor determinado pelo método DNSA (SUMMER, 1924). O biorreator teve sua atividade testada em fluxos ascendente e descendente e velocidades de 0,03-0,48 L/h. A estabilidade operacional foi determinada usando fluxo ascendente em sistema aberto por 30 horas.
RESULTADOS E DISCUSSÃO: O fluxo ascendente foi mais eficiente apresentando a maior taxa de conversão (20,1%), este pode ter diminuído a interferência de “regiões mortas” do biorreator (BORZANI et al, 2001) em relação ao fluxo descendente (7,24%). Na menor velocidade de fluxo (0,03 L/h), a taxa máxima de conversão foi 20,3% enquanto que no fluxo mais rápido (0,48 L/h), o máximo de conversão foi de 56,9% no mesmo tempo (Figura 1). Os fluxos com velocidade de até 0,12 L/h em reatores de leito fixo são fortemente afetados pelas limitações difusionais devido à transferência externa de massa, mas com o aumento da velocidade do fluxo este deixa de ser uma grande limitação possibilitando a ocorrência de melhores taxas de conversão (BORZANI et al, 2001). O biorreator perdeu apenas 13,54% (inicial - 2,57 g/L e final - 1,81 g/L) de sua atividade após 30h em operação. Isto pode ocorrer devido à inativação da enzima (BAYRAMOGLU et al, 2003) ou lixiviamento da enzima do suporte (PU) durante o uso devido ao fluxo (MORIMOTO et al, 2006). O tempo de meia vida (T½) do biorreator foi de 79,2 h maior que o obtido por Bayramoglu (2003) em aproximadamente 34 horas, com invertase imobilizada em filme de poli(HEMA–GMA).
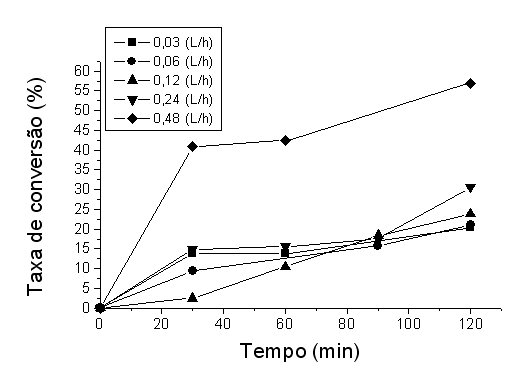
CONCLUSÕES: O biorreator de leito fixo contendo 130U de atividade invertase mostrou maior eficiência em fluxo ascendente (20,1%) e o máximo de conversão (56,9%) na maior velocidade de fluxo. Favorecido por uma maior circulação do substrato através do biorreator, maior transferência de massa e maior energia cinética das moléculas. Após 30 horas em estabilidade operacional, o biorreator perdeu 13,54% da sua atividade inicial a 20°C, com um tempo de meia-vida de 79,2h. Estes resultados estimulam um estudo futuro deste tipo de biorreator em escala piloto para a produção de açúcar invertido.
AGRADECIMENTOS:LIKA, PIBIC/ UFPE/CNPq, HEBRON e FINEP.
REFERÊNCIAS BIBLIOGRÁFICA:AKGÖL, S., KAÇAR, Y., DENIZLI, A., ARICA, M. Y. 2001. Hydrolysis of sucrose by invertase immobilized onto novel magnetic polyvinylalcohol microspheres Food Chemistry, 74: 281-288.
ANITA, A., SASTRY, C.A., HASHIM, M.A. 1997. Urease Immobilized on Nylon: Preparation and Properties. Bioprocess Engineering, 17: 241-245.
BAYRAMOGLU, G., AKGOL, S., BULUT, A., DENIZLI, A., ARICA, M.Y. 2003. Covalent immobilisation of invertase onto a reactive film composed of 2-hydroxyethyl methacrylate and glycidyl methacrylate: properties and application in a continuous flow system. Biochemical Engineering Journal, 14: 117–126.
BORZANI, W. 2001. Biotecnologia industrial. São Paulo: Edgard Blucher, ISBN 8521202784.
CHEN, Y. E. T., KANG, K.G., NEOH, K. L., 2000. Covalent immobilization of invertase onto the surface-modified polyaniline from graft copolymerization with acrylic acid. European Polymer Journal, 36: 2095-2103.
DANISMAN, T., TAN, S., KACAR, Y., ERGENE, A. 2004. Covalent immobilization of invertase on microporous pHEMA–GMA membrane, Food Chemistry, 85: 461-466.
GRATÃO, A.C.A; BERTO, R.I.; SILVEIRA JÚNIOR, V. 2004. Reologia do Açúcar líquido invertido: Influência da temperatura na viscosidade. Ciência e Tecnologia dos Alimentos, 24: 652-656.
LEVENSPIEL, O. 2000. Engenharia das reações químicas. 3.ed. São Paulo: Ed. Edgar Blucher, ISBN 852120275X.
MORIMOTO, K., PARK, C.S., OZAKI, M., TAKESHITA, K., SHIMONISHI, T., GRANSTROM, T.B. TAKATA, G. TOKUDA, M., IZUMORI, K. 2006. Large scale production of D-allose from D-psicose using continuous bioreactor and separation system. Enzyme and Microbial Technology, 38: 855–859.
SUMMERS, J.B. 1924. The estimation of sugar in diabetic urine, using dinitrosalicyclic acid. Journal of Biology chemistry, 62: 287-290.
ROZMAN, H. D.,YEO, Y. S., TAY, G. S., ABUKABAR, A. 2003. The Mechanical and physical properties of polyuretane composites based on rice husk and polyethylene glycol. Polymer testing, 22: 617-623.
