ÁREA: Bioquímica e Biotecnologia
TÍTULO: IMUNOSSENSOR PIEZOELÉTRICO PARA DETERMINAÇÃO DA TROPONINA T CARDÍACA HUMANA EM TEMPO REAL EMPREGANDO MONOCAMADA AUTO-ORGANIZADA
AUTORES: MATTOS, A.B. (UPE) ; FREITAS, T.A. (UPE) ; CAVALCANTI, I. T. (UPE) ; SILVA, M.M.S. (UPE) ; DUTRA, R.F. (UPE) ; SILVA, V.L. (UFPE)
RESUMO: RESUMO: Um imunossensor piezoelétrico por injeção de fluxo foi desenvolvido para detectar em tempo real a Troponina T cardíaca humana (TnT). Anticorpo monoclonal específico (anti-TnT) foi imobilizado sobre o eletrodo de ouro de um cristal de quartzo (10MHz) empregando monocamada auto-organizada de alcanotióis. A faixa linear de resposta variou até 11,0 ng/mL (R=0,994; p<0,001) combinado a um baixo erro relativo de 4.1%. O imunossensor foi reutilizado removendo o complexo anti-TnT-TnT pela injeção de Dodecil Sulfato de Sódio 1% (p/v). A determinação da TnT foi realizada em amostras de soros humanos mostrando a viabilidade do imunossensor como dispositivo rápido e prático para o diagnóstico do Infarto Agudo do Miocárdio (IAM).
PALAVRAS CHAVES: imunossensor piezoelétrico; monocamada auto-organizada; troponina t cardíaca humana
INTRODUÇÃO: INTRODUÇÃO: As troponinas do músculo cardíaco são atualmente consideradas marcadores altamente específicos na injúria miocárdica comparados às creatinoquinase e a desidrogenase láctica (CAMERON et al., 2007). No entanto, as determinações das troponinas nem sempre estão disponíveis nos sistemas de saúde por apresentarem custos mais elevados. A identificação da elevação nos níveis de troponina tem a vantagem de possibilitar a detecção precoce do IAM, visto que estes aumentam concomitante à extensão da necrose das células cardíacas (STIELGER et al., 2000). Neste contexto, os dispositivos piezoelétricos como imunossensores mostram-se atrativos, pois por dispensarem o uso de substâncias marcadoras (anticorpos conjugados) apresentam respostas rápidas e podem ser portáteis (LU et al., 2004). A interação anti-TnT e TnT é medida imediatamente pela alteração de freqüência elétrica do dispositivo, fornecendo respostas em tempo real, o que vem orientar de modo prático, rápido e seguro, a intervenção terapêutica do IAM. O procedimento de imobilização é a principal etapa na construção dos imunossensores. O uso de monocamadas auto-organizadas (SAMs) como técnica de imobilização assegura uma orientação não-aleatória e homogênea dos anticorpos sobre a superfície do eletrodo contribuindo para obtenção de imunossensores com maior estabilidade e reprodutibilidade (DONG, 2005; FREIRE et al., 2003). O objetivo deste trabalho consistiu em desenvolver um imunossensor através do sistema piezoelétrico por injeção de fluxo empregando SAM, de forma a permitir a imobilização do anticorpo anti-TnT sobre o imunossensor contribuindo no diagnóstico do IAM.
MATERIAL E MÉTODOS: MATERIAL E MÉTODOS: Um sistema piezoelétrico em fluxo foi utilizado para determinar a concentração da TnT. Este sistema foi constituído por célula de fluxo, eletrodo de quartzo (10 MHz, Universal Sensors, USA), bomba peristáltica (Chromatograph,Japão) e circuito oscilador conectado a um frequencímetro digital (Agillant, modelo 011, USA) com saída para registro do sinal em um microcomputador. A variação da freqüência elétrica foi proporcional à concentração de TnT ligada aos anticorpos anti-TnT imobilizados na superfície do eletrodo de quartzo. Filmes de alcanotióis foram utilizados para imobilizar os anticorpos anti-TnT de modo orientado. A superfície do eletrodo, inicialmente, foi limpa com uma solução "piranha" (3H2SO4:1H2O2) para remoção de impurezas adsorvidas e após lavagem com água ultra-pura, uma solução de 25mM de 2-aminoetanotiol (CIS) foi incubada por 2h seguida por solução de glutaraldeído (GLUT) 2.5% (v/v) por 45 min. Após obtenção do filme de alcanotiol, anticorpos anti-TnT (1mg/L) foram incubados por 1 h. Para remover ligações não específicas, uma solução de 10mM de glicina foi usada para bloquear os grupos aldeídicos não reagentes. As respostas das interações anti-TnT às concentrações de TnT foram medidas em tempo real pela variação de freqüência elétrica. O complexo anti-TnT-TnT formado pode ser removido aplicando solução de SDS 1% (p/v) por 3 min para reuso do imunossensor.
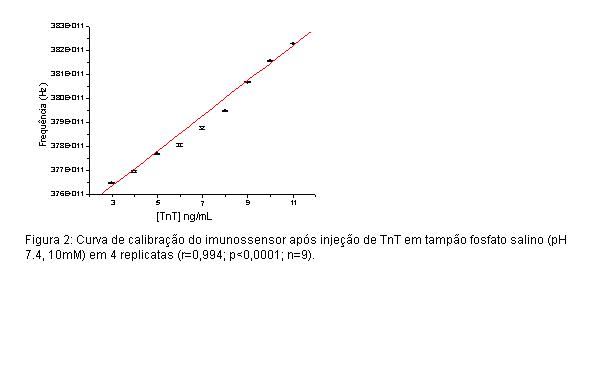
RESULTADOS E DISCUSSÃO: RESULTADOS E DISCUSSÃO: A modificação do eletrodo e o processo de imobilização do Anti-TnT esta ilustrado na Fig.1. Efeitos na quantidade de anti-TnT imobilizados em função da concentração de CIS foi investigado e de acordo com os resultados a concentração de 25mM de CIS foi a ideal para imobilização dos anticorpos (LIU et al., 2006). Durante a preparação da SAM os resultados mostraram que, com injeção da solução de CIS 25mM na célula de fluxo, o deslocamento da freqüência foi de 1,14 KHz com baixo coeficiente de variação (CV=10,1%) devido a SAM viabilizar fortes interações entre a superfície eletródica e o grupo tiol (FREIRE et al., 2003). Após incubação do GLUT 2.5% (v/v) um deslocamento de 1,81 KHz foi observado. Neste ensaio, o tempo de incubação do GLUT foi controlado em 45 minutos e boa reprodutibilidade foi alcançada (CV=13.6%, n=6). A estratégia de regeneração é um fator importante na redução de custos de um imunossensor piezoelétrico. Alguns estudos indicam soluções do NaOH de 0.1M para remover o imunocomplexo (PARK et al., 2004). Neste trabalho, o emprego de uma solução de SDS 1% (p/v) promoveu a remoção total do antígeno. De acordo com a figura 2, a curva de calibração do imunossensor apresentou uma elevada linearidade r = 0.994 (p <0.0001,n=9), combinado a um baixo erro relativo de 4.1% com faixa linear de resposta até 11,0 ng/mL. Um estudo comparativo com amostras de soro foi realizado comparando as determinações de TnT do biossensor com as de analisadores automáticos (Roche Elecsys 2010). Os resultados mostraram boa concordância com intervalo de confiança de 95%.
CONCLUSÕES: CONCLUSÕES: Um imunossensor piezoelétrico empregando SAM de tióis foi desenvolvido para detectar em tempo real a TnT com níveis de detecção similares aos encontrados em analisadores automáticos. Estes resultados mostram a viabilidade do imunossensor em ensaios clínicos, permitindo a detecção rápida e de modo prático de um importante marcador da injúria cardíaca.
AGRADECIMENTOS: AGRADECIMENTOS: À FACEPE e CAPES pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: REFERÊNCIAS BIBLIOGRÁFICAS: CAMERON, S. J.; SOKOLL, L. J.; LATERZA, O. F.; SHAH, S.; GREEN, G. B. 2007. A multi-marker approach for the prediction of adverse events in patients with acute coronary syndromes. Clinica Chimica Acta, 376: 168-173.
DONG, Y. 2005. The frequency response of QCM in electrochemically characterizing the immobilization on gold electrode. Sensors and Actuators B: Chemical, 108: 622-626.
FREIRE, S. R.; PESSOA, C. A.; KUBOTA, L. T. 2003. Emprego de Monocamadas Auto-Organizadas no Desenvolvimento de Sensores Eletroquímicos. Química Nova, 26: 381-389.
LIU, Y.; LU, H.; ZHONG, W.; SONG, P.; KONG, J.; YANG, P.; GIRAULT, H.H.; LIU, B. 2006. Multilayer-assembled microchip for enzyme immobilization as reactor toward low-level protein identification. Anal. Chem.,78:801-808.
LU, F.; LEE, H. P.; LIMA, S. P. 2004. Quartz crystal microbalance with rigid mass partially attached on electrode surfaces. Sensors and Actuators A, 112: 203–210.
PARK, I-S.; KIM, D-K.; ADANYI, N.; VARADI, M.; KIM, N. 2004. Development of a direct-binding chloramphenicol sensor based on thiol or sulfide mediated self-assembled antibody monolayers. Biosensors and Bioelectronics, 19:667-674.
STIEGLER, H.; FISCHER, Y.; VAZQUEZ-JIMENEZ, J. F.; GRAF, J.; FILZMAIER, K.; FAUSTEN, B.; JANSSENS, U.; GRESSNER, A. M.; KUNZ, D. 2000. Cardiac Troponin T and I Results in Heparin-Plasma Than in Serum. Clinical Chemistry, 46: 1338-1344.
