ÁREA: Iniciação Científica
TÍTULO: RECUPERAÇÃO DO COBRE EM DESCARTES DE AULAS PRÁTICAS
AUTORES: VEIGA, S.C.P. (UEG) ; SOARES, F.A. (UEG) ; SILVA, D.S. (UEG) ; SILVA, M.N. (UEG)
RESUMO: Este trabalho apresenta um estudo realizado sobre a viabilidade econômica da regeneração dos resíduos químicos gerados em laboratórios de ensino de graduação. O modelo adotado para a avaliação da viabilidade econômica de utilização de regenerado de resíduos e sua aplicação no próprio laboratório foi baseado em dados teóricos de literatura e em dados experimentais obtidos em pesquisas de laboratório. Minimizando a estocagem dos resíduos nas atividades de ensino, existente nos laboratórios de Inorgânica, Analítica e Físico-química.
O investimento neste estudo é bem pequeno, valendo mais para o aprendizado do aluno A economia com alguns reagentes torna-se significativa diminuindo os custos operacionais e viabilizando a regeneração como alternativa para o tratamento e disposição destes resíduos.
PALAVRAS CHAVES: cobre residual, custos, recuperação de resíduos
INTRODUÇÃO: O cobre é um metal de transição avermelhado, que apresenta condutibilidade elétrica e térmica só superada pela da prata, industrialmente é um dos metais mais importantes devido sua alta ductibilidade e maleabilidade. Os elementos do sub grupo do cobre funcionam tanto como cátions como ânions completos.(N.S.Armetov,1995) No grupo do cobre destacam-se os minerais cuprite (Cu2O), malaquite (CuCO3.Cu(OH)2), azurite (2CuCO3.Cu(OH)2) e crisocola (CuSiO3.2H2O). É um oligoelemento essencial para muitas formas de vida, entre elas para o ser humano, todos compostos de cobre deveriam ser tratados como se fossem tóxicos, uma quantidade de 30g de sulfato de cobre é potencialmente letal em humanos. O sulfato de cobre II é um composto de cobre que é empregado na agricultura como fungicida, na purificação da água e como conservante da madeira. Atualmente é produzido mundialmente cerca de 940 milhões de toneladas de cobre (US Geological Survey). O ciclo do cobre metálico, chama-se assim porque é um conjunto de reações que começam no cobre para formar cobre metálico outra vez, é um processo de reciclagem do cobre.
MATERIAL E MÉTODOS: Os descartes das soluções de cobre resultantes das aulas práticas da UEG foram aquecidos para evaporação do excesso de líquido, formando assim uma solução concentrada, onde após este aquecimento adiciona-se uma quantidade de água destilada. Adiciona-se uma solução de H2SO4 6 mol/L, afim de reduzir o pH. Coloca-se a quantidade estequiométrica de Zn em pó, notando-se uma grande liberação de gás conseqüente da reação de redução do zinco sobre o cobre,essa liberação finda quando o líquido sobrenadante fica incolor, podendo então decantar e descartar o líquido. Em seguida lava-se três vezes a solução com água destilada e o mesmo procedimento com acetona, transfere-se o cobre decantado a um vidro relógio levando-o a estufa com 75ºC durante aproximadamente 15 minutos, colocando logo apos no dessecador e em seguida pesa-se.(ANDRADE, J.C.2005)
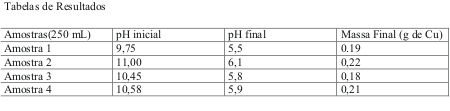
RESULTADOS E DISCUSSÃO: Inicialmente determinou-se o pH das amostras contendo cobre, as quais foram aquecidas para liberação de substâncias voláteis, desnecessárias, deixando-as concentradas. A utilização da água destilada após o aquecimento proporcionou a diluição das amostras e o balanceamento do pH. Devido a reação de redução do zinco sobre o cobre necessitar de um pH ácido para ocorrer foi adicionado o ácido sulfúrico. A duração da reação de oxirredução(conforme reação abaixo) foi de aproximadamente 24 horas, obteve-se um precipitado de cor vermelho e brilho intenso, o qual foi lavado com água e acetona para retirar as impurezas. Para se obter um resultado quantitativo final o precipitado foi levado a estufa a 75oC eliminando a água. Finalmente pesou-se em balança analítica para verificação do teor de cobre das soluções analisadas.
CuSO4(aq) + Zn(s) → Cu(s) + ZnSO4 (aq)
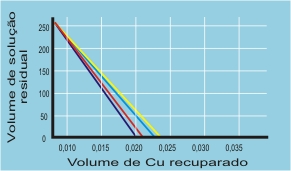
CONCLUSÕES: Podemos verificar que o método do ciclo do cobre, para recuperação deste metal, é eficiente, sendo que a quantidade recuperada foi satisfatória em relação ao custo benefício. È um método simples e barato, sendo que o cobre é um metal nobre de alto custo, e também poluidor. A tendência de recuperação de resíduos faz com que as universidades busquem medidas simples, baratas e eficazes para as recuperações.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: Baccan, N.; Andrade, J.C., de; Godinho, O.E.S. & Barone, J.S. - "Química Analítica Quantitativa Elementar", 3a. ed., UNICAMP - Campinas/SP, Edgard Blucher, (2001), 308pp.;
Harris, D.C. - "Análise Química Quantitativa"- 5a. ed., (Riehl, C.A.S. e Guarino, A.W.S, trads.), Rio de Janeiro, LTC-W.H.Freeman (1999), 862pp.;
