ÁREA: Iniciação Científica
TÍTULO: Oclusão de NH4NO3 em poros da zeólita 4A –Estudo da liberação controlada em água e em solo simulado
AUTORES: ROLIM, J. C. (UFC) ; LOIOLA, A. R. (UFC) ; SILVA, L. R. D. (UFC)
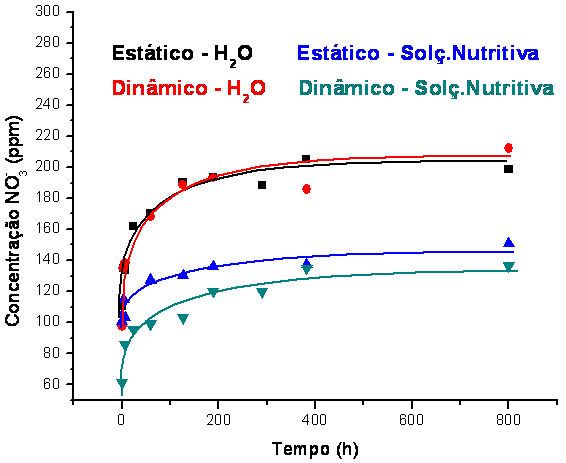
RESUMO: Foi obtida uma zeólita da classe LTA a partir de um caulim, e em seguida a mesma foi submetida à oclusão de nitrato de amônio em sua estrutura porosa. Os ensaios de liberação gradual de nitrato ocorreram sob condições em água e em solução salina, durante 32 dias. A velocidade inicial de liberação de nitrato medida na água foi de 0,91 mg.s-1.L-1 e 0,96 mg.s-1.L-1 em condições estáticas e dinâmicas, respectivamente. Na solução salina a velocidade inicial foi de 0,46 mg.s-1.L-1 e 0,50 mg.s-1.L 1 em condições estáticas e dinâmicas, respectivamente. Acredita-se que a baixa liberação de nutrientes em solução foi devido à presença dos sais. O ritmo de liberação foi portanto, satisfatório, em vista de uma possível utilização em solos agrícolas.
PALAVRAS CHAVES: caulim; zeólita; nh4no3
INTRODUÇÃO: As zeólitas (aluminosilicatos de cadeia aberta) sintéticas apresentam uma série de vantagens sobre as naturais. Segundo BRECK (1974), isto acontece devido a possibilidade de controle sistemático do processo de síntese. Tem sido desafiadora a síntese de zeólita com elevada pureza, quando a fonte de silício e alumínio é uma argila. Dentre os minerais de argila utilizados como substratos, o grupo do caulim (argila: filossilicatos; do grego, phyllos significa ‘folha’, ou lamela) é o mais importante (LIN et al., 2004). Nas últimas décadas tem-se verificado um extraordinário avanço no desenvolvimento de materiais para os mais diversos usos. Especificamente, no campo da síntese de materiais microporosos como as zeólitas, as pesquisas não estão mais restritas ao uso em catálise e adsorção (CUNDY et al., 2003).
Por exemplo, os aluminossilicatos, em especial as argilas, são bem conhecidos por exercerem efeitos benéficos aos solos. Isto se deve a sua capacidade em reter água e exercer trocas iônicas de espécies importantes para a agricultura, como sódio, potássio, cálcio, nitrogênio, entre outros. As zeólitas podem da mesma forma, acomodar uma quantia apreciável de sal como NH4NO3, podendo servir como uma boa fonte de nutrientes de plantas. Alguns autores (BERNARDI et al., 2005; CHANDRASEKHAR et al., 2001), entre outros, tem sugerido a utilização de zeólitas na oclusão de minerais de nitrogênio. Dentre os materiais mencionados encontra-se um tipo específico de zeólita, a P-1, em um sistema que simula um solo agrícola. Estes relatos motivaram o desenvolvimento desta pesquisa, que visa a obtenção de uma zeólita baixo silício (4A ou NaA), com capacidade para a oclusão de nitrato de amônio e posterior liberação (cinética) controlada do mesmo em meio que simule um solo agricultável.
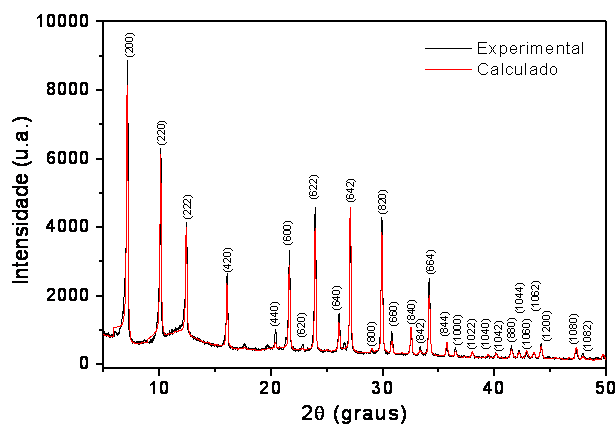
MATERIAL E MÉTODOS: A síntese (formação de um sol-gel) realizada consistiu de várias etapas: calcinação, formação do gel, envelhecimento, cristalização, lavagem e secagem (COSTA et al., 1988). Com isso, a partir de um caulim modificado e sob condições hidrotérmicas chegou-se à estrutura de alta pureza da zeólita 4A, da qual foi caracterizada morfologicamente por microscopia eletrônica de varredura, granulometria e difração de raios-X, identificando as fases cristalográficas (software High-Score) com base nos padrões do PDF e refinando pelo Método de Rietveld a partir do padrão de difração de pó usando o software DBWS9807, onde foram realizados ajustes de diversos parâmetros tais como a largura de pico a meia altura, coeficientes assimétricos, fator de escala, parâmetros de rede e parâmetros polinomiais de linha de fundo (YOUNG, 1995). A sua estabilidade térmica (TGA) foi verificada através de parâmetros termocinéticos aplicando o modelo de Osawa. Este estudo avaliou também a cinética de liberação controlada de nitrogênio (NH4+ e NO3-) da estrutura porosa da zeólita 4A ocluida com NH4NO3, a partir de um modelo que simula um solo. Empregando metodologia baseada na literatura (PARK et al., 2005), foram ocluídos no estado sólido cerca de 20% m/m de nitrato de amônio, maceramento seguido de aquecimento. Que após várias lavagens resultou em um material com cerca de 10% m/m. O êxito do processo foi confirmação através de análises termogravimétricas (MOTHÉ et al., 2002), fotometria de chama (OKUMURA et al., 2004), espectroscopia molecular na região do infravermelho e espectrofotometria da região do UV (OLIVEIRA et al., 2007). Os ensaios de liberação gradual de nitrato ocorreram sob condições controladas de temperatura, pH e condutividade em água e em solução salina em condições estáticas e dinâmicas, conduzidos durante 32 dias.
RESULTADOS E DISCUSSÃO: Os resultados do refinamento indicaram 100% da zeólita 4A (COVARRUBIAS et. al., 2006). Os resultados da distribuição granulométrica estão de acordo com os da microscopia, onde os cristais apresentaram forma cúbica. Determinações termogravimétricas de sua estabilidade indicaram um comportamento similar ao da zeólita comercial (WEITKAMP, 2000). O número de eventos observados no DSC é compatível com os verificados na TGA e indica que H2O e NH3 interagem de forma distinta com a zeólita (ESPOSITO et al., 2004), conforme sugerem os valores de energia de ativação. O processo de oclusão do sal teve sua confirmação a partir do espectro no infravermelho. Em ensaios utilizando solução salina, contendo sais de Ca, Mg, K, e zeólita ocluida, deram como resultados a liberação de Na+ (troca iônica com Ca2+), NO3- e NH4+ (PARK et al., 2001). Isto ocorre nas primeiras horas, atingindo o equilíbrio em tempos prolongados. Este comportamento tem indicado que a relação íons-mobilidade é o fator determinante. A velocidade inicial medida na água foi de 0,91 mg.s-1.L 1 e 0,96 mg.s-1.L 1 em condições estáticas e dinâmicas, respectivamente. Nas medidas em solução salina a velocidade inicial foi de 0,46 mg.s-1.L 1 e 0,50 mg.s-1.L 1 em condições estáticas e dinâmicas, respectivamente. Acredita-se que a baixa liberação de nutriente em solução salina se deve à presença de Na+, K+, Ca2+ e Mg2+ , em conseqüência da competição entre essas espécies durante a liberação do nitrato, notadamente o Ca2+, o qual identificou-se por fotometria de chama como espécie que ocluiu na zeólita, pois teve sua concentração diminuída, em substituição ao Na+, cuja concentração na solução aumentou, espécie originalmente presente na estrutura da mesma.
CONCLUSÕES: Os estudos sistemáticos das propriedades de liberação de sais ocluidos são necessários para explorar as potencialidades de zeólitas como fertilizantes eficientes e condicionadores de solo, visto que a interação entre o nutriente e os poros da zeólita ocorre de forma distinta. As proporções molares e as condições diagenéticas pré-estabelecidas resultaram na obtenção da zeólita NaA. Os resultados mostraram, portanto, ser viável o uso da zeólita sintetizada, e contendo nitrogênio, como fonte de nutrientes vegetais.
AGRADECIMENTOS: Os autores agradecem a UFC pela infra-estrutura fornecida, ao Laboratório de Raios-X e Análise térmica da UFC, e ao PIBIC-CNPq e CAPES pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: BERNARDI, A. C. C.; V.-BERNARDI, M. R.; WERNECK, C. G.; HAIM, P. G.; MONTE, M. B. M. 2005. Produção, aparência e teores de nitrogênio, fósforo e potássio em alface cultivada em substrato com zeólita. Horticultura Brasileira, 23: 920-924.
BRECK, D.W., Zeolites: molecular sieves. 1974, New York: John Wiley & Sons, Inc.
CHANDRASEKHAR, S.; PRAMADA, P.N. 2001. Sintering behaviour of ammonium exchaged low silica zeolites synthesised by two different routs. Ceramics International, 27: 351-361.
COSTA, E.; LUCAS, A.; UGUINA, M. A.; RUIZ, J. C. 1988. Synthesis of 4A zeolite from calcined kaolins for use in detergents. Ind. Eng. Chem. Res., 27: 1291-1296.
COVARRUBIAS, C.; GARCÍA, R.; ARRIAGADA, R.; YÁNEZ, J.; GARLAND, M. T. Cr(III) exchange on zeolites obtained from kaolin and natural mordenite. Microporous and Mesoporous Materials, 2006. 88: p. 220–231.
CUNDY, C.S. 2003. The hidrothermal synthesis of zeolites: history and development from the earliest days to present time. Chem. Rev., 103: 663-701.
ESPOSITO, S.; FERONE, C.; PANSINI, M.; BONACCORSI, L.; PROVERBIO, E. 2004. A comparative study of the thermal transformations of Ba-exchanged zeolites A, X and LSX. Journal of the European Ceramic Society, 24: 2689–2697
LIN, D.-C.; XU, X.-W.; ZUO, F.; LONG, Y.-C. 2004. Crystallization of JBW, CAN, SOD and ABW type zeolite from transformation of meta-kaolin. Microporous and Mesoporous Materials, 70: 63-70.
MOTHÉ, C. G.; AZEVEDO, A. D. 2002. Análise Térmica de Materiais. São Paulo: i ditora.
OKUMURA, F.; CAVALHEIRO, E. T. G.; NÓBREGA, J. A. 2004. Experimentos simples usando fotometria de chama para ensino de princípios de espectrometria atômica em cursos de química analítica. Quim. Nova, 27: 832-836.
OLIVEIRA, F. M. 2007. Aplicação e testes do método APHA-4500-NO3-C para determinação de nitratos em águas por leitura em UV com segunda-derivada Revista Analytica, 27: p. 80-88.
PARK, M.; KIM, J. S.; CHOI, C. L.; KIM, J.-E.; HEO, N. H.; KOMARNENI, S.; CHOI, J. 2005. Characteristics of nitrogen release from synthetic zeolite Na-P1 occluding NH4NO3. Journal of Controlled Release, 106: 44-50.
PARK, M.; SHIN, S.C.; CHOI, C.L.; LEE, D.H.; LIM, W.T.; KOMARNENI, S.; KIM, M.C.; CHOI, J.; HEO, N.H. 2001. Role of framework on NH4NO3 occlusion in zeolite pores. Microporous Mesoporous Mater., 15: 91-99.
WEITKAMP, J. 2000. Zeolites and catalysis. Solid State Ionics, 131: 175-188.
YOUNG, R.A. 1995. DBWS-9411 - an upgrade of the DBWS programs for Rietveld Refinement with PC and mainframe computers. J. Appl. Cryst., 28: 366-367.
