ÁREA: Iniciação Científica
TÍTULO: SÍNTESE HIDROTERMAL DE UM COMPLEXO DE RUTÊNIO(II)
AUTORES: PASSOS, C.S. (UFS) ; RODRIGUES, M.O. (UFS) ; SANTOS, S.C.G. (UFS) ; MESQUITA, M.E. (UFS) ; SUSSUCHI, E.M. (UFS)
RESUMO: O ligante 2,2’-bipiridina-1,1’-dióxido foi sintetizado com o intuito de obter o complexo de rutênio [Ru(x-bpy)3]2+ (x-bpy = 2,2’-bipiridina-1,1’-dióxido) utilizando o método de síntese hidrotermal.
As caracterizações do ligante bipiridínico e do complexo sintetizado foram realizadas através de voltametria cíclica e espectroscopia na região do IV, análise elementar e na região do UV-vis.
PALAVRAS CHAVES: síntese hidrotermal; complexo de rutênio; ligante bipiridínico
INTRODUÇÃO: Nos últimos anos, muitos complexos de rutênio têm sido preparados e caracterizados com vistas às suas aplicações em fotólise, química bioinorgânica, hidrogenação assimétrica catalítica e outras.
Os complexos de rutênio com ligantes polipiridínicos como a bipiridina têm sido largamente empregados devido à estabilidade e às propriedades eletroquímicas e fotoquímicas. No campo da química supramolecular, esses compostos também têm recebido grande interesse, devido à ocorrência de várias geometrias e números de coordenação, e à possibilidade de se obter supermoléculas por meio de reações de automontagem e à capacidade de se regenerarem espontaneamente.
O método hidrotermal, utilizado para a síntese do complexo de rutênio, ocupa lugar de destaque no que se refere à síntese de sólidos (WALTON, et al. 2002; CHEN, et al. 2003).
De fato, a síntese hidrotermal é a mais bem difundida metodologia usada para síntese principalmente de redes de coordenação, pois permite a criação de fases cristalinas de qualidade mesmo em sistemas que não são estáveis no ponto de fusão (KNAUSS, et al. 2001), além disso, o método hidrotérmico possibilita superar as barreiras energéticas de ativação, que no âmbito termodinâmico do processo é o pré-requisito necessário para iniciar a nucleação de uma fase metastável (DAVEY, et al. 2000). Outro aspecto interessante associado à técnica advém das diversas vias de otimização das condições de sínteses como: variação da temperatura, pressão, volume do solvente, pH, quantidade e relação molar entre os reagentes (GO, et al. 2005).
MATERIAL E MÉTODOS: Na síntese do ligante 2,2’-bipiridina-1,1’-dióxido e do complexo de rutênio(II), foram utilizados reagentes e solventes de qualidade apropriada.
* Síntese do ligante 2,2’-bipiridina-1,1’-dióxido (DONNICI, et al.1998; NAVARRO, et al.1996): Em um balão, foram colocados 25,0 ml de ácido acético glacial, 3,32 g (21,28 mmol) de 2,2’-bipiridina e 11,5 ml de peróxido de hidrogênio (35%). A mistura foi aquecida a 80C, durante 3 horas; após este período foram adicionados 5,7 ml de H2O2 (35%) e a mistura foi mantida sob aquecimento por um período adicional de 18 horas sob a mesma temperatura. A mistura foi concentrada até cerca de 15,0 ml, e foram adicionados 12,2 ml de água destilada. Esta mistura foi reduzida a um volume de 15,0 ml e alcalinizada com uma solução saturada de carbonato de sódio. A seguir foi rotoevaporada e a mistura foi armazenada na geladeira por 24 horas. Foi obtido um precipitado branco que foi coletado em funil de placa sinterizada. O rendimento foi de 61,09%.
* Síntese do complexo (WALTON, et al.2002; CHEN, et al.2003): O complexo [Ru(x-bpy)3]2+ (x-bpy = 2,2’-bipiridina-1,1’-dióxido) foi obtido através de adição de 0,037g de RuCl3 (1,78x10-4mol), 0,100g do ligante 2,2’-bipiridina-1,1’-dióxido (5,32x10-4mol) em 4,0 mL de água destilada . A mistura foi adicionada em um autoclave de inox revestido com teflon (8,0 mL), fechado hermeticamente e aquecido até uma a temperatura de 170 °C e mantido isotermicamente por 72 horas. Em seguida o reator foi resfriado a temperatura ambiente. O sólido resultante foi lavado com água destilada gelada, após a secagem em dessecador apresentou rendimento de 48,54%.
RESULTADOS E DISCUSSÃO: Na síntese do ligante 2,2’-bipiridina-1,1’-dióxido, houve algumas mudanças na rota original. Como não precipitou com a alcalinização, foi necessário rotoevaporar e manter na geladeira por 24 horas. O ligante foi caracterizado através da espectroscopia na região do IV, apresentando uma banda forte em 1258 cm-1 que é atribuída à freqüência de estiramento N-O. Esta banda é sensível ao efeito eletrônico dos substituintes da bipiridina, podendo variar de 1300 a 1200 cm-1, dependendo das suas propriedades doadoras ou receptoras.
O complexo [Ru(x-bpy)3]2+ (x-bpy = 2,2’-bipiridina-1,1’-dióxido) foi sintetizado, seguindo o método hidrotermal descrito na literatura (WALTON, et al. 2002; CHEN, et al. 2003). As caracterizações do complexo foram realizadas por voltametria cíclica e de pulso diferencial anódico, análise elementar e espectroscopia na região do UV-vis.
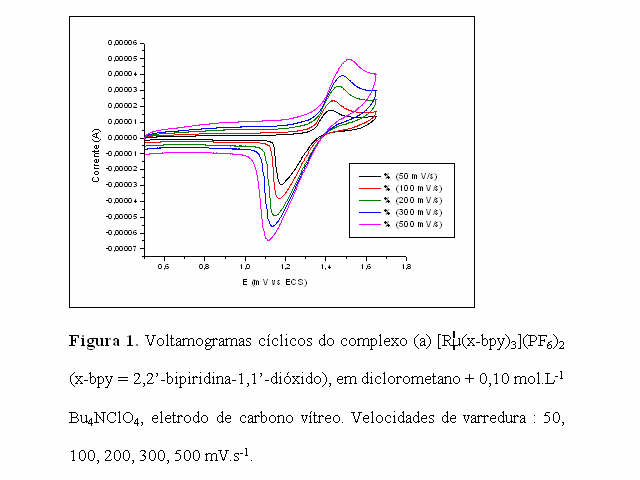
O comportamento voltamétrico do complexo foi estudado em solução de diclorometano contendo perclorato de tetrabutilamônio como eletrólito suporte em diferentes velocidades de varredura, os quais possuem comportamentos similares. Apresentaram um par redox atribuído ao sistema Ru(III/II), sendo o pico anódico em + 1,44 V e o pico catódico em 1,17 V (vs ECS), velocidade de varredura 100 mV.s-1.
Os potenciais de oxidações aumentam com o aumento da velocidade de varredura. (Fig. 1); e o valor de corrente do pico catódico (Ipc) aumenta linearmente com o aumento da raiz quadrada da velocidade de varredura.
O complexo obtido apresentou banda de absorção na região do visível em 449 nm, que é atribuída à transição de transferência de carga metal-ligante (TCML), por comparação com outros complexos citados na literatura (Du, et al.2006).
CONCLUSÕES: A síntese do complexo [Ru(x-bpy)3](Cl)2 (x-bpy = 2,2’-bipiridina-1,1’-dióxido) foi obtida com rendimentos e pureza satisfatórios; sendo necessário procedimentos de recristalizações para se obter o composto puro.
Técnicas de caracterizações, tais como, voltametria cíclica e espectroscopia na região do IV e na região do UV-Vis confirmaram a obtenção dos compostos.
Pode-se concluir que a síntese hidrotermal é uma metodologia alternativa eficiente para a obtenção de complexos de rutênio (II).
AGRADECIMENTOS: PIBIC/CNPq; COPES/CAPES
REFERÊNCIAS BIBLIOGRÁFICA: CHEN Y. M.; WANG E. B.; LIN B. Z.; WANG S. T., The first polyoxoalkoxovanadium germanate anion with a novel cage-like structure: solvothermal synthesis and characterization. Journal-Chemical Society Dalton Transactions, p. 519, 2003.
DAVEY, R.; GARSIDE, J., From molecules to cristallizers; an introduction to crystallization. Oxford Chemistry Primers, 2000.
DONNICI, C. L.; MÁXIMO, D. H. F.; MOREIRA, L. L. C.; REIS, G. T.; CORDEIRO, E. S.; OLIVEIRA, I. M. F.; CARVALHO, S.; PANIAGO, E. B., J. Braz. Chem. Soc., p.455, 1998.
DU, I. ; QI, B. ;YANG, X. ; WANG, E., J. Phys. Chem. B, p.21662, 2006.
WALTON R. I., Subcritical solvothermal syntesis of condensed inorganic materials. Chemical Society Reviews , p. 230, 2002.
KNAUSS, K. G.; DIBLEY, M., J., Ti(IV) hydrolysis constants derived from rutile solubility measurements made from 100 to 300°C. Applied Geochemistry, v. 16, p. 1115, 2001.
GO, Y. B.; WANG, X.; ANOKHINA, E. V.; JACOBSON, A. J., Influence of the temperature and pH on coordination modes of 1,4-benzenedicarboxilate (BDC) ligand: A case of the NiII(BDC)/2,2´-bipyridine system. Inorganic Chemistry, v. 44, p. 8265, 2005.
NAVARRO, M.; GALEMBECK, S. E.; ROMERO, J. R.; DE GIOVANI, W. F.; Polyhedron, p. 1531, 1996.
