ÁREA: Química Inorgânica
TÍTULO: SÍNTESE E ESTUDO ESTRUTURAL DE COMPLEXOS DE COBRE(II) COM N-BENZOIL-GUANIDINAS
AUTORES: DE SOUZA, A.R. (IQ/UFG) ; QUINTINO, M.P. (IQ/UFG) ; FERREIRA, R.M.M. (IQ/UFG) ; SABINO, J.R. (IF/UFG) ; CUNHA, S. (IQ/UFBA)
RESUMO: Foram preparados e caracterizados os complexos: dicloro[N-benzoli-N’-(4-metilfenil)-N”-(2-piridinil)guanidina]cobre(II), [Cu(bmpg)2Cl2]; e dicloro[N-Benzoil-N’-cicloexil-N”-(2-piridinil)guanidina]cobre(II), [Cu(bcpg)2]H2O. A análise de difração de raios-X mostra a coordenação do ligante ao íon metálico Cu(II) pelos nitrogênios imínico da guanidina e pirídinico, formando anéis de seis membros. Dois íons cloretos são coordenados ao íon cobre(II), levando a uma geometria tetraédrica distorcida. Bandas de absorção eletrônica na região de 27000 cm-1 foram atribuidas LMTC dos nitrogênios guanidiníco ou pirídinico para o metal e 15000 cm-1 as transições d-d. Os espectros IV mostraram vibrações características do grupo guanidina em 1620 cm-1, deslocadas da frequência do ligante livre.
PALAVRAS CHAVES: guanidina, cobre(ii), cobre(ii)-guanidina
INTRODUÇÃO: A constante demanda por novos sistemas ligantes que suportam centros metálicos cataliticamente ativos, pressiona a química de coordenação a desenvolver compostos cada vez mais elaborados. Durante a procura por sistemas mais sofisticados, classes de moléculas relativamente simples, com potencial para satisfazer as características desejadas, são frequentemente esquecidas. Até certo ponto, guanidinas podem ser enquadradas nessa categoria [Coles, 2006].
Guanidinas são moléculas orgânicas que possuem em sua estrutura um carbono sp2 ligado a três átomos de nitrogênio. Sua estrutura permite a fomação de diferentes estruturas N,N’,N’’-substituídas, sendo este um dos fatores mais atrativos na utilização dessas moléculas como ligantes. Guanidinas são bases fortes, cuja basicidade está relacionada à estabilidade de seus ácidos conjugados (íon guanidínio). Essa característica dá a essa classe de moléculas uma flexibilidade estéreo-eletrônica capaz de gerar diferentes modelos de coordenação quando ligadas a íons metálicos [Bailey & Pace, 2001]. Além disso, a exploração das guanidinas como ligantes, tem mostrado que as propriedades associadas com seus substituintes têm efeito pronunciado na química dos complexos resultantes [Coles, 2006]. Em função disso, o principal interesse nesse trabalho foi estutar complexos de cobre(II)-guanidinas, centrado na potencial aplicação em catálise oxidativa desses sistemas. Nesse trabalho, será apresentado dois novos compostos de cobre(II) com as N-benzoil-guanidinas: BMPG: N-benzoli-N’-(4-metilfenil)-N”-(2-piridinil)guanidina; BCPG: N-Benzoil-N’-cicloexil-N”-(2-piridinil)guanidina, cujas estruturas moleculares foram resolvidas por difração de raios-X.
MATERIAL E MÉTODOS: A guanidina utilizada na síntese do complexo foi sintetizada conforme descrito em [Cunha, 2001]. Os complexos foram sintetizados reagindo uma solução da guanidina em clorofórmio com uma solução de cloreto de cobre (II) em metanol, na proporção de 2:1 sob agitação constante por duas horas. Cristais vermelho do [Cu(bmpg)2Cl2] e verde do [Cu(bcpg)2]H2O foram obtidos por difusão lenta em diclorometano e éter de petróleo. A caracterização dos complexos foi realizada por análise elementar, espectroscopia na região de IV e a análise estrutural por difração de raios-X, método do mono-cristal.
[Cu(bmpg)2Cl2]: Rendimento: 92%; PF: 195-198°C; Análise elementar para C20H18CuN4OCl2: calculado: C 51,68 H 3,90 N 12,05, experimental: C 50,83 H 3,93 N 10,78%; IV: 3398w, 3033vw, 2993vw, 1685w, 1647vs, 1624vs, 1599m, 1545m, 1599w, 1458m, 1259w, 1217w, 772w e 710w cm-1.
[Cu(bcbg)2Cl2]H2O: Rendimento: 94%; PF: 166-169°C; Análise elementar para C19H24CuN4O2Cl2: calculado: C 48,06 H 5,09 N 11,80 experimental: C 48,52 H 4,87 N 11,24%; IV: 3217vw, 3072vw, 2934w, 2853vw, 1648vs, 1606m, 1583m, 1448m, 1316w, 1292w, 1029vw, 1004vw, 773w e 710 vw cm-1.
RESULTADOS E DISCUSSÃO: As estruturas moleculares dos complexos [Cu(bcpg)Cl2].H2O e [Cu(bmpg)Cl2] fornecidas pelas análises de difração de raios-X (Figuras 1 e 2) apresentam, respectivamente, as N-benzoil-guanidinas coordenadas ao íon metálico Cu(II) pelo nitrogênio imínico da guanidina Cu1-N3 (1,957Å) e Cu1-N3 (1,965 Å) e pelo nitrogênio pirídinico Cu1-N11 (2,008 Å) e Cu1-N11 (1,993 Å), formando anéis de seis membros. Além disso, dois cloretos são coordenados diretamente ao íon cobre(II) Cu1-Cl1 e Cu1-Cl2 (2,2165 e 2,2118 Å, respectivamente) e Cu1-Cl1 e Cu1-Cl2 (2,218 e 2,217 Å, respectivamente), levando a uma geometria tetraédrica distorcida para o átomo de cobre(II) em ambos. Os comprimentos das ligações entre os átomos do ligante, cloretos e cobre(II) nos complexos são comparáveis com os valores obtidos na literatura [Fernandez-G, et al., 2002; Montes-Ayala, et al., 2005].
As bandas de absorção eletrônica nos complexos podem ser observadas, além das bandas de transição dos ligantes, bandas de transferência de carga ligante → metal (LMTC) na região de 22000 a 30000 cm-1, provavelmente, relacionadas a transferência de carga dos átomos de nitrogênio do grupo guanidina ao íon cobre(II). São observadas bandas de transferência de carga do tipo N → Cu(II) na região de aproximadamente 22000 cm-1, característica da transferência de carga do nitrogênio piridínico para o metal e bandas de absorção referentes a transição d-d na região do visível e infravermelho próximo. Tais características são esperadas para cromóforos tetragonais com distorções tetraédricas [Lever, 1968].
Os espectros IV dos complexos mostraram que vibrações características do grupo guanidina em torno de 1620 e 3310 cm-1, foram deslocados da freqüência do ligante livre, indicando a participação desse grupo na coordenação.
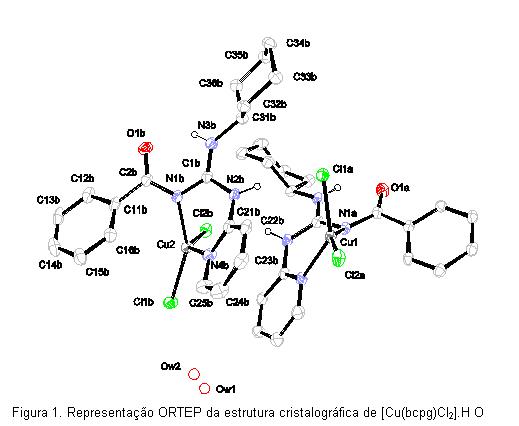
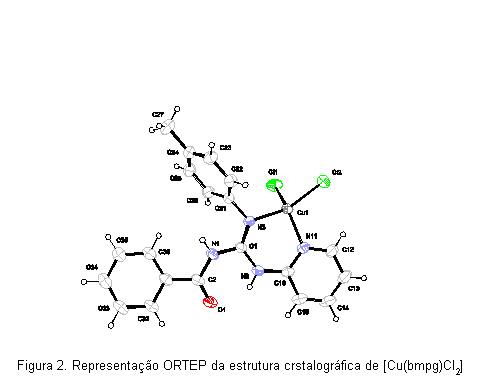
CONCLUSÕES: A análise estrutural dos compostos mostra que os ligantes N-benzoil-guanidina foram compostos estáveis com cobre(II) coordena-se, preferenciamente, pelo nitrogênio imínico da guanidina e pelo nitrogênio pirídinico, formando anéis de seis membros, relativamente estáveis. Além disso, dois íons cloretos são coordenados diretamente ao íon cobre(II), levando a uma geometria tetraédrica distorcida.
AGRADECIMENTOS: Os autores agradecem ao CNPq, CAPES e FUNAPE/UFG
REFERÊNCIAS BIBLIOGRÁFICA: Bailey, P. J., Pace, S., Chemistry Reviews, 214, 91, 2001.
Coles, M. P., Dalton Transation, 8, 985, 2006
Cunha, S., Costa, M. D., Napolitano, H. B., Lariucci, C., Vencato, I., Tetrahedron, 57, 1671, 2001.
Lever, A. B. P., Inorganic electronic spectroscopy, Chemistry York university, Elsevier Publishing company, New York, p. 417, 1968.
Montes-Ayala, J., Escartín-Guzmán, C., Castillo-Blum, S. E., Rodríguez-Hernández, E. O., Bernès, S., Rosales-Hoz, J., Barba-Behrens, N., J. Inorga. Biochem. 99, 1657, 2005.
