ÁREA: Físico-Química
TÍTULO: ESTUDO CINÉTICO E TERMODINÂMICO DO FENÔMENO DE MUTARROTAÇÃO DA D-GLICOSE
AUTORES: H. F. N. OLIVEIRA (UNICAMP) ; C. E. PERLES (UNICAMP) ; P. L. O. VOLPE (UNICAMP)
RESUMO: Este trabalho mostra aspectos pouco discutidos na literatura sobre o comportamento da molécula de D-glicose em solução aquosa. Quando dissolvida ocorre o fenômeno de mutarrotação, onde o anômero alfa (cerca de 90% dos cristais) é espontaneamente convertido ao beta atingindo o equilíbrio com cerca de 64% do anômero beta. O calor do processo foi obtido através da microcalorimetria, revelando uma contribuição entalpica favorável à espontaneidade (DG<0). A partir da constante de equilíbrio deste fenômeno verificou-se que a contribuição entrópica não é menos importante que a entalpica. Uma verificação experimental do aumento de entropia foi feita pelo monitoramento da variação de densidade em função do tempo. A cinética do processo foi estudada através de medidas polarimétricas.
PALAVRAS CHAVES: mutarrotação d-glicose
INTRODUÇÃO: Glicose é o carboidrato mais importante e abundante na natureza, extremamente utilizado na natureza como substrato para síntese de outras substâncias importantes.
Em solução aquosa, assim como outros poliidroxialdeídos, adota a forma cíclica. No caso da glicose a conformação molecular mais estável é a conformação em cadeira (Heathcock, C.H. e col. 1992).
A molécula de glicose em solução sofre um fenômeno conhecido como mutarrotação, observado pela primeira vez em 1846 (Heathcock, C.H. e col. 1992), mas somente compreendido após a descoberta de que os carboidratos estão presentes em solução na forma cíclica, com somente uma pequena parcela da forma acíclica (Voet, D e col. 1995).
Após a dissolução dos cristais de glicose, o fenômeno de interconversão entre as formas alfa e beta ocorre continuamente até estabelecimento de um equilíbrio termodinâmico entre ambas as formas. Em solução aquosa de glicose seis formas coexistem em equilíbrio, onde as formas alfa, beta e aldose acíclica (Voet, D e col. 1995; Angyal, S.J. 1991), são as formas mais importantes na discussão do processo de mutarrotação. As formas alfae beta são isômeros ópticos conhecidos e diferem um do outro somente pela configuração do centro quiral C-1, carbono hemiacetal.
Devido ao fato das formas alfa e beta serem isômeros opticamente ativos, a técnica direta de monitoramento da cinética do processo de mutarrotação em solução é polarimetria, que foi empregada neste estudo com o intuito de conhecer-se melhor a cinética deste fenômeno. O calor de reação (entalpia) foi monitorado através da técnica de calorimetria, utilizando-se um microcalorímetro isotérmico e a variação de volume molar foi monitorado indiretamente através de densitometria, fornecendo informações sobre a termodinâmica do processo.
MATERIAL E MÉTODOS: D-glicose pura (Synth) foi utilizada para preparar soluções 100 g.L-1 para o estudo cinético (polarimetria) e soluções 72 g.L-1 para os estudos termodinâmicos (microcalorimetria e densitometria).
Polarimetria
As medidas polarimétricas foram realizadas utilizando um polarímetro automatizado (PerkinElmer 341). Os experimentos forma realizados com lâmpada de sódio, cujo comprimento de onda é 589 nm, e cela polarimétrica termostatizada com caminho óptico de comprimento 0,1 dm.
Densitometria
A variação da densidade da solução de D-glicose foi acompanhada ao longo do processo de mutarrotação. Preencheu-se a cela do densímetro DMA-450 (Anton Paar) com, aproximadamente, 1mL de solução de glicose recém preparada.
A solução foi mantida dentro da cela do densímetro, a temperatura de 298,15K, durante todo o tempo do experimento e os valores de densidade foram periodicamente registrados por um microcomputador.
Calorimetria
Os experimentos microcalorimétricos foram realizados em um calorímetro isotérmico (Thermometric 2277–TAM) equipado com cela de fluxo contínuo confeccionada em ouro, com volume nominal de 0,600 ml.O fluxo contínuo foi mantido através de uma bomba peristáltica LKB-Pharmacia.
O canal de fluxo do microcalorímetro foi eletricamente calibrado num fundo de escala de 100 W antes de todos os experimentos. A calibração foi feita com canal totalmente preenchido com água, sem fluxo.
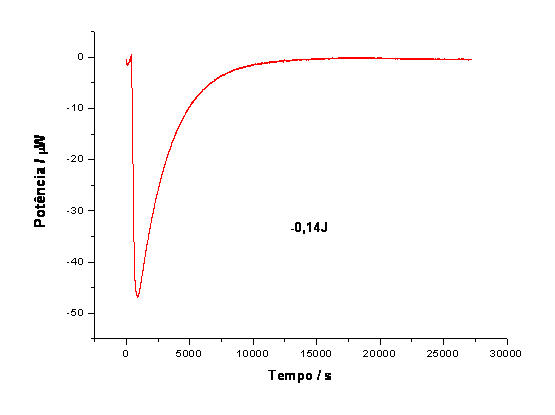
RESULTADOS E DISCUSSÃO: Através da calorimetria obtivemos curvas de P vs. t (figura 2), cuja integral nos dá o calor total Q da reação (-0,14J). Com a equação 1 e os valores de Q e número de mols, n, de glicose dentro da cela calorimétrica obtivemos DH:
DH = Q/n = -0,58 kJ.mol-1 (1)
No equilíbrio temos uma rezão 64:36 entre os anômeros alfa e beta. Esta razão foi obtida através de curvas de concentração versus tempo. As concentrações dos anômeros foram obtidas através dos dados polarimétricos e as equações 2-5.
[rot.alfa] = rot.alfa/L.Conc.alfa = +112°(2)
[rot.beta]= rot.beta/L.Conc.beta = +19°(3)
rot.(alfa+beta)= rot.alfa + rot.beta(4)
Conc.alfa+ Conc.beta = 10g.100mL-1(5)
Onde rot. se refere a rotação óptica e Conc. a concentração da espécie.
As eq. 6-8 atreladas aos valores de concentrações dos dois anômeros no equilíbrio e DH obtidos nos levam aos valores de DG e DS que são -1,43 kJ.mol-1 e +2,85 mJ.K-1.mol-1, respectivamente.
K = [anômero beta] / [anômero alfa] (6)
DG = -RTlnK (7)
DG = DH - TDS (8)
Considerar pequeno o efeito entrópico devido à pequena DS é um erro, pois se verificarmos a contribuição do termo TDS (+0,85 kJ.mol-1) observamos que ele é responsável por 59% da energia livre. Esta predominância de efeito entrópico se dá essencialmente pelo novo arranjo molecular do sistema adquirido, o que se confirma pelo aumento de volume molar em função do tempo.
A tabela 1 mostra as constantes de velocidade obtidas em diferentes temperaturas. Estas constantes foram obtidas através dos dados polarimétricos, curva L vs. t e as eq. 9 e 10.
L = ln[(rot.0 - rot.eq.)/(rot.t - rot.eq.)] (9)
dL/dt = k (10)
Com os dados da tabela 1 e a equação de Arrhenius (eq. 11)obtivemos a energia de ativação deste fenômeno: Ea = 72 kJ.mol-1.
lnk = lnA - Ea/(RT) (11)

CONCLUSÕES: A contribuição da entropia é mais significativa do que a variação de entalpia, uma vez que no valor da variação desta estão contidos os fenômenos de hidrólise e de solvatação, cujas contribuições para DH não são conhecidas.
Através variação da densidade foi possível constatar que o anômero beta apresenta volume molar maior fato este reforçado pelo valor de DS. Um conhecimento mais aprofundado deste efeito será em breve investigado utilizando-se cálculos teóricos.
Os dados polarimétricos permitiram obter as constante de velocidade do processo assim como a sua energia de ativação.
AGRADECIMENTOS: Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: Angyal, S.J., Adv. Carboh. Chem. Biochem. 1991, 49, 19-35.
Streitwieser, A.; Heathcock, C.H.; Kosower, E.M. Introduction to Organic Chemistry 1992 , 4nd ed., Maxwell Macmillan International; pp 910 – 914.
Voet, D.; Voet, J.G. Biochemistry 1995 , 2nd ed., John Wiley & Sons; pp. 254 –255.
