ÁREA: Ambiental
TÍTULO: Tratamento de efluente urbano por vias fotoeletroquímicas
AUTORES: SILVA, A.H.Q. (UFAL) ; ZANTA, C.L.P.S. (UFAL) ; TONHOLO, J. (UFAL)
RESUMO: No tratamento de resíduos e na redução do impacto ambiental, a eletroquímica tem se destacado por se tratar de um processo limpo. Essa tecnologia se torna mais interessante quando utilizados ânodos dimensionalmente estáveis (ADE). Com ADE tem-se a possibilidade de se realizar o processo eletroquímico foto-assitido. Esse trabalho estudou a aplicabilidade do processo fotoeletroquímico no tratamento de efluente contaminado com esgoto urbano. Os estudos indicaram que o processo fotoeletroquímicos é bastante eficiente para o tratamento desse efluentes, apresentando a redução de aproximadamente 70% da DQO. ADE comercial, alem de mais eficiente, também apresentou maior estabilidade. Os estudos com ADE preparados em laboratório mostraram que a eficiência aumenta com concentração de RuO2.
PALAVRAS CHAVES: fotoeletroquimica, esgoto urbano, ade
INTRODUÇÃO: O esgoto doméstico é responsável por 90% dos lançamentos que contaminam os corpos d’água (KRESSE, 1997). Esta porcentagen ressalta a importância de desenvolvimento de tecnologias apropriadas para o tratamento desse resíduo.
Segundo NOGUEIRA e JARDIM (1998), entre os processo de descontaminação ambiental, os “Processos Oxidativos Avançados” (POA) vêm atraindo grande interesse por serem bastante eficiêntes. Entre os POA, pode-se citar os processos que envolvem a utilização do ozônio, reação de Fenton ou foto-Fenton e semicondutores como dióxido de titânio(PIGNATELLO et al., 2006).
Associada aos processos oxidativos avançados, a tecnologia eletroquímica pode ser uma forma eficiente e versátil de controle de poluição. (FÓTI, 1992; COMNINELLIS, 1994). Quando utilizados os ânodos Dimensionalmente Estáveis (ADE) o processo de degradação ou mineralização pode ocorre através de radicais hidroxila (OH°) ou atraves óxidos superiores do tipo MOx+1. Estas duas espécies (MOx+1 e OH°) têm a função de oxidar os compostos orgânicos (BERTAZZOLI e PELEGRINI, 2002). Os radicais hidroxilas apresentam uma alta reatividade favorecendo a total mineralização dos compostos orgânicos (NOGUEIRA e JARDIM, 1998). Já a reação através das espécies MOx+1 é mais lenta e mais seletiva.
Segundo PELEGRINI et al. (1999, 2000) o uso dos eletrodos de óxido, tipo ADE, permite ainda que a eletrólise possa ser assistida pela fotocatálise heterogenia, gerando o processo fotoeletroquímico.
Nesse trabalho decidiu-se estudar a aplicabilidade do processo fotoeletroquimico no tratamento de um efluente real contaminado por esgoto urbano utilizando-se ADE como material eletródico.
MATERIAL E MÉTODOS: Neste estudo foi utilizado como material eletródico ADE comercial e produzidos no próprio laboratório. Os ânodos utilizados foram das seguintes composições: ELETRODO COMERCIAL contendo 34% de dióxido de rutênio (RuO2) e 66% de dióxido de titânio (TiO2) produzido pela DeNora do Brasil; ELETRODOS PREPARADOS NO LABORATÓRIO contendo 30% de RuO2 e 70% de TiO2; 50% de RuO2 e 50% de TiO2; e 90% de RuO2 e 10% de TiO2. Os eletrodos são representados por Ti/Ru0,34Ti0,66O2, Ti/Ru0,30Ti0,70O2; Ti/Ru0,50Ti0,50O2 e Ti/Ru0,90Ti0,10O2 respectivamente. Como cátodo utilizou-se ADE comercial.
Os eletrodos feitos no laboratório foram preparados através de decomposição térmica de sais precursores. A metodologia de preparação é descrita na literatura (Zanta et al. 2000).
Amostras de água foram obtidas no Riacho da Cruz das Almas – Maceió-AL, tendo sido coletas a 200 metros antes do seu descarte na praia.
Voltamogramas cíclicos foram registrados entre 0,1 V a 1,1 V vs. Ag/AgCl, Cl- utilizando como eletrólito de suporte ácido sulfúrico 0,5 M em meio aquoso aplicando-se a velocidades 50 mV s-1.
Eletrólises a potencial constante foto-assistidas foram realizadas para todas as composições eletródicas em triplicata. Em cada experimento foi utilizado 700mL da água do efluente in natura, ou seja, sem a adição de nenhum reagente. No caso do efluente estudado, o mesmo apresenta alta salinidade, permitindo conduzir as eletrólises sem adição de eletrólito. Como fonte de radiação utilizou-se uma lâmpada mista está localizada a 50 cm da parte superior da cela eletroquímica. As eletrólises foram conduzidas por 2 horas, tendo sido coletado amostras de solução para análise de DQO (APHA, 1995).
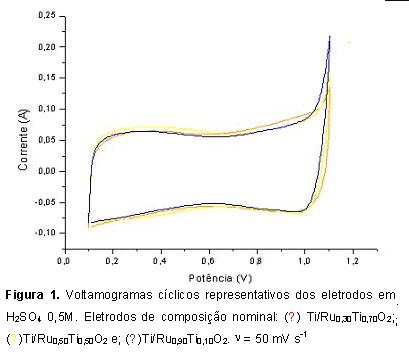
RESULTADOS E DISCUSSÃO: Voltamogramas dos eletrodos preparados em laboratório são apresentados na Figura 1. Os voltamogramas são característico dos eletrodos contendo RuO2 onde se observa uma banda entre 0,2 a 0,5V devido a transferência eletrônica da dupla Ru(III)/Ru(IV) e um suave ombro entre 0,8 a 1,0V devido a formação de óxidos superiores Ru(IV)/Ru(VI) (SILVA et al., 2001).
Nos voltamogramas pode ser observado a mesma carga voltamétrica entre 0,1 a 1,0V. A carga é um parâmetro representativo da área superficial, indicando que os eletrodos apresentam a mesma área eletroquimicamente ativa. Acima de 1,0V (onde ocorre a RDO) pode ser observado o aumento da corrente anódica sendo proporcional a concentração de RuO2.
Voltamogramas registrados antes e após as eletrólises mostram que o eletrodo comercial apresenta maior estabilidade, tendo sido observado pela menor redução da carga voltamétrica. Para todos os eletrodos preparados no laboratório observou-se maior redução da carga voltamétrica além da deformação do voltamograma, comportamento característico do aumento da resistência ôhmica devido à perda da camada de óxido.
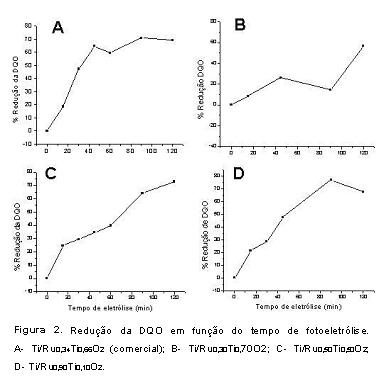
Eletrólises a potencial constante de 8,30 V foram realizadas sob a incidência de luz e o resultado das análises de DQO são apresentadas na Figura 2. Na Figura 2 verifica-se que o eletrodo comercial apresenta maior eficiência para a redução da DQO, pois observou-se a diminuição de aproximadamente 60% da DQO após 40 minutos de eletrólise.
Para as composições eletródicas preparadas em laboratório a redução da DQO foi maior para a composição com maior concentração de RuO2. Sendo a mistura eletródica composta por RuO2 (eletrocatalítico) e TiO2 (fotocatalítico) podemos então afirmar que o processo eletroquímico é mais eficiente que o fotocatalítico.
CONCLUSÕES: Os estudos indicaram que o processo fotoeletroquímicos é bastante eficiente para o tratamento de efluentes urbano apresentando a redução de aproximadamente 70% da DQO. A composição comercial apresentou maior eficiência e estabilidade em relação às demais composições. Os estudos com as composições preparadas em laboratório mostraram que a eficiência aumenta com concentração de RuO2 na composição eletródica, indicando que o processo eletroquímico apresenta maior contribuição para o tratamento do efluente que o processo fotoquimico.
AGRADECIMENTOS: Os autores agradecem a CNPq\CTPetro, CAPES e FAPEAL
REFERÊNCIAS BIBLIOGRÁFICA: APHA. 1995. Standard methods for the examination of water and wastewater, 19th ed. Washington, DC, USA.
BERTAZZOLI, R.; PELEGRINI, R. 2002. Descoloração e degradação de poluentes orgânicos em soluções aquosas através do processo fotoeletroquímico. Química Nova, 25: 477-482.
COMNINELLIS, Ch. 1994, Electrocatalysis in the electrochemical conversion/combustion of organic pollutants for wastewater treatment. Electrochim. Acta, 39: 1857.
FÒTI, G.; GANDINI, D.; COMNINELLIS, Ch. 1992. Anodic oxidation of organics on thermally prepared oxide electrodes. Current topics in Electrochemistry, 5: 71.
KRESSE, K. 1997. Água potable y saneamiento: Los avances en los últimos años son insuficientes. Desenvolvimento e Cooperação. Berlin, 2: 26-29.
NOGUEIRA, R. F. P.; JARDIM, W. F. 1998. A fotocatálise hetrogênea e sua aplicação ambiental. Química Nova, 21: 1-10.
PELEGRINI, R.; ZAMORA, P.P.; ANDRADE, A.R de; REYES, J. 1999. Electrochemically Assisted Photocatalytic Degradation of Reactive Dyes. Applied Catalysis A, 22: 83-90.
PELEGRINI, R. ; REYES, J ; CABALLERO, N. E. D.; ZAMORA, P. P.; ANDRADE, A R de. 2000. Photoelectrochemical Degradation of Lignin. Journal of Applied Electrochemistry, 30: 953-958.
PIGNATELLO, J.; OLIVEROS, E.; MACKAY, A. 2006. Advanced Oxidation Processes for Organic Contaminant Destruction Based on the Fenton Reaction and Related Chemistry. Critical Reviews in Environmental Science and Technology, 36: 1-84.
SILVA, L. M.; BOODTS, J. F. C.; FARIA, L.A. 2001. Oxygen evolution at RuO2(x)+Co3O4(1-x) electrodes from acid solution. Electrochimica Acta, 46: 1369.
ZANTA, C.L.P.S.; ANDRADE, A. R. de; BOOTDS, J.F.C. 2000. Electrochemical behaviour of olefins: oxidation at ruthenium-titanium dioxide and iridium-titanium dioxide coated electrodes. J. Appl. Electrochem., 30: 467.
