ÁREA: Produtos Naturais
TÍTULO: Estudo do perfil de ácidos graxos de fungos fitopatogênicos
AUTORES: DE OLIVEIRA, M.C.F. (UFC) ; MONTENEGRO, T.G.C. (UFC) ; PRAXEDES, A.C.R. (UFC) ; DE LEMOS, T.L.G. (UFC) ; ARRIAGA, A.M.C. (UFC) ; ANDRADE-NETO, M. (UFC) ; MAFEZOLI, J. (UNIFOR) ; VIANA, F.M.P (EMBRAPA) ; TERAO, D. (EMBRAPA) ; PESSOA, M.N.G (UFC)
RESUMO: O perfil de ácidos graxos é uma ferramenta de grande importância na identificação de microrganismos, logo o objetivo deste trabalho foi analisar o perfil de ácidos graxos de espécies e isolados de diferentes fungos fitopatogênicos. Os fungos foram cultivados em meio líquido e os óleos foram hidrolisados e metilados para posterior analise por CG/EM. Os ácidos hexadecanóico (C16:0) foi identificado como majoritário para os fungos do gênero Colletotrichum. Para Lasiodiplodia theobrome, o constituinte majoritário foi o ácido 13-octadecenóico (C18:1w5c). Aspergillus niger apresentou como constituinte majoritário os ácidos 9-octadecenóico (C18:1w9c) e octadecadienóico (C18:2), e para Fusarium palidorosium os majoritários foram os ácidos hexadecanóico (C16:0) e 9-octadecenóico (C18:1w9c).
PALAVRAS CHAVES: fungos, ácidos graxos, colletotrichum
INTRODUÇÃO: Estudos da composição de ácidos graxos têm sido realizados com o objetivo de auxiliar na taxonomia de várias espécies de fungos (CHEN et al., 2001). Comparação de amostras de fungos com composições de ácidos graxos similares demonstrou que essas espécies têm estatisticamente algumas diferenças. Análises discriminantes mostraram que tais composições são diferentes em alto nível de significância (STAHL & KLUNG, 1996).
O objetivo do presente trabalho foi analisar o perfil de ácidos graxos de espécies de Colletotrichum, a fim de dar uma contribuição à taxonomia deste gênero, bem como comparar este perfil com os de fungos Aspergillus, Fusarium e Lasiodiplodia theobrome.
MATERIAL E MÉTODOS: Foi realizada uma seleção de fungos (Tabela 1) isolados de vários frutos tropicais e depositados na micoteca da EMBRAPA – Agroindústria Tropical. Os microrganismos foram cultivados em placas de Petri contendo o meio BDA (batata, dextrose e Agar) à 29 °C por aproximadamente 7 dias e após transferidos para frascos erlenmeyers de 250 mL contendo meio líquido BD (batata-dextrose). Foram utilizados 5 frascos erlenmeyers de 250 mL, contendo 150 mL do meio de cultura BD, sendo 4 frascos com fungos e 1 como controle. Após 15 dias de crescimento, o micélio (biomassa) foi separado do meio líquido por filtração a vácuo. Ao micélio foram adicionados 100 mL de metanol o qual foi retirado após 24h gerando a fração metanólica. O micélio foi extraído com hexano onde se obteve a fração hexânica 1. A fração metanólica foi concentrada, dissolvida em acetonitrila e particionada com hexano por 2 vezes, obtendo-se a fração hexânica 2, a qual foi agrupada à fração hexânica 1. Os óleos foram saponificados com uma solução 0,5 Mol/L de KOH em metanol, e os ácidos livres, foram convertidos em seus ésteres metílicos utilizando o reagente (BF3)-metanol (50% Aldrich®) sob refluxo. Os ésteres métilicos foram dissolvidos em CHCl3 em e injetados em CG/EM QP5050A da SHIMADZU, com impacto eletrônico de 70 eV acoplado ao cromatógrafo gás-líquido modelo CG 17A; coluna capilar DB-1 (dimetilpolisiloxano) com 30 m de comprimento; 0,25 mm de diâmetro externo e um filme de 0,25 μm; gradiente de temperatura 1 ºC/min de 80 a 280 ºC; temperatura do injetor de 280 ºC. A identificação dos ésteres metilicos dos ácidos graxos foi realizada através da comparação dos tempos de retenção com os dados disponíveis na espectroteca, e co-injeção com ésteres metílicos padrões da Supelco® e comparação com dados da li
RESULTADOS E DISCUSSÃO: No presente estudo foram detectados um total de 21 ácidos graxos, dos quais 18 foram identificados, sendo 8 saturados, 9 insaturados e 4 ramificados. Dentre estes, apenas os ácidos C16:0 e C18:0 estiveram presente em todos os fungos analisados. Todos os isolados de C. gloeosporioides, C. musae e F. palidorosium apresentaram o ácido C16:0 como majoritário. C. acutatum, diferentemente das demais espécies de Colletotrichum, apresentou o ácido C18:1ω8c como majoritário. L. theobromae apresentou uma grande variedade de ácidos graxos, porém em baixas concentrações, tendo como majoritário o ácido C18:1ω5c. O ácido C17:1 foi identificado apenas nesta espécie. Para o fungo A. niger foi identificado o ácido C18:1ω5c como majoritrário. Os ácidos 12-Me-C14:0, 14-Me-C15:0 e C24:0 foram identificados apenas em F. palidorosium e os ácidos 17-Me-C18:0 e C22:0 foram identificados apenas em C. gloeosporioides isolado da banana e C. graminicola, respectivamente. Os teores dos ácidos graxos identificados encontram-se na Tabela 2.
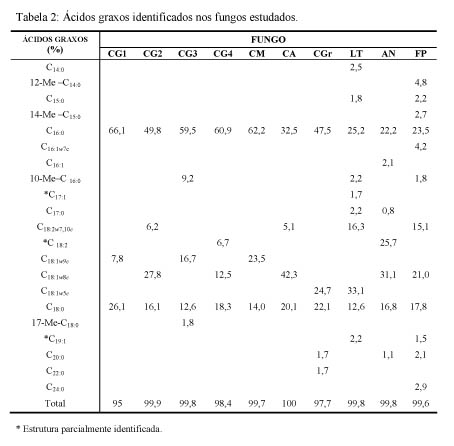
CONCLUSÕES: Um total de 21 ácidos graxos foi detectado e um perfil diferenciado foi observado para as diferentes espécies. Embora os ácidos hexadecanóico (C16:0) e octadecanóico (18:0) tenham sido identificados em todos os fungos, a proporção dos mesmos variou em função da espécie. O ácido hexadecanóico (C16:0) mostrou-se um possível marcador quimiotaxonômico de C. gloeososporioides, uma vez que foi encontrado em concentrações elevadas em todas as amostras de isolados analisadas. Embora o ácido tetradecanóico (C14:0) tenha sido identificado somente em L. theobromae, faz-se necessário mais estudos.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: CHEN, J. H.; FERRIS, K. M.; SCOW, K. J., 2001, Fatty acid composition and dynamics of selected fungal-feeding nematodes and fungi, Comparative Biochemistry and Physiology Part B, 130, 135-144.
CHRISTIE, W. W.; The Lipid Library, Mass Spectrometry of Fatty Acids Derivatives, http://www.lipidlibrary.co.uk/index.html, acesso em 20/08/2006.
KONOVA, I. V.; GALAMINA, L. A.; KOCHKINA, G. A., 2005, The Prevalence of cis-9-Hexadecenoic Acid is a Specific Feature of the Fatty Acid Profile of Zygomycetes from the Order Kickxellales Microbiology, 74 (1), 99-103.
STAHL, P. D.; KLUNG, M. J., 1996, Characterization and Differentiation of Filamentous Fungi Based on Fatty Acid Composition, Applied and Environmental Microbiology, 62, 4136-4146.
