ÁREA: Produtos Naturais
TÍTULO: COMPOSIÇÃO QUÍMICA DO ÓLEO ESSENCIAL DE PIPER CALLOSUM E SUA TOXICIDADE
AUTORES: ANDRADE, E.H.A. (UFPA) ; GUIMARÃES, E.F. (IPJBRJ) ; SILVA, J.K.R. (UFPA) ; MAIA, J.G.S. (UFPA) ; BASTOS, C.N. (CEPLAC)
RESUMO: RESUMO: Neste trabalho apresenta-se a composição química do óleo essencial de um exemplar de P. callosun, propagado por sementes no Município de Marituba, PA e sua toxicidade obtida por bioensaios com Artemia salina (larvas de camarão), com a determinação da concentração letal média (CL50). O óleo essencial foi obtido por hidrodestilação e analisado através de CG e CG-EM. Foram identificados 48 componentes químicos no óleo essencial, apresentando o fenilpropanóide safrol com o teor de 78%.
PALAVRAS CHAVES: piper callosum, safrol, toxicidade
INTRODUÇÃO: INTRODUÇÃO: A família Piperaceae compreende 12 gêneros e cerca de 1400 espécies, com distribuição principalmente pantropical (1). Piper é o gênero com maior número de espécies, cerca de 700, das quais mais de 170 ocorrem no Brasil (2). A família Piperaceae é representada por plantas herbáceas, trepadeiras, arbustos e, raramente, árvores. Espécies de Piper são grandes produtoras de óleos essenciais. Fenilpropanóides voláteis possuem acentuada atividade biológica contra insetos. Os compostos fenilpropanoídicos são responsáveis em grande parte pela atividade biológica que algumas espécies de Piper da Amazônia apresentam. Entre estes, incluem-se apiol, dilapiol, miristicina, elemicina, eugenol, metileugenol, etilpiperonilcetona e safrol, todos encontrados em óleos essenciais de Piper já estudadas pelo nosso grupo. Piper callosum, popularmente conhecido como elixir-paregórico, ventre-livre, óleo-elétrico, etc., é utilizada como adstringente, digestiva, antidiarréica, hemostática local, antileucorréica, etc.(ALBUQUERQUE,1989 e VIEIRA, 1991).
MATERIAL E MÉTODOS: MATERIAL E METODOS: Folhas e galhos finos de Piper callosum coletados no campus do CEPLAC, Marituba, Pará foram secas a temp. amb., durante 7 dias e submetidas à hidrodestilação por 3h, usando um sistema de Clevenger. O óleo obtido foi seco com Na2SO4 anidro, fornecendo 3,0% em rendimento. A composição química do óleo essencial foi analisada através de CG (Focus-DIC) e CG/EM em sistema Thermo DSQII com col. capilar de sílica OV-5 (30m x 0,25 mm;0,25 mm de espessura do filme) nas seguintes condições operacionais: prog. de temp.: 60°C-240°C (3°C/min); espectros de massas: impacto eletrônico a 70eV. A identificação dos componentes voláteis foi baseada no índice de retenção linear calculado em relação aos tempos de retenção de uma série homóloga de n-alcanos e no padrão de fragmentação observados nos espectros de massas, por comparação destes com amostras autenticas existentes nas bibliotecas do sistema de dados e da literatura (ADAMS, 2001).O óleo essencial foi submetido ao bioensaio da citoxicidade frente às larvas de Artemia salina, cujos ovos (25 mg) foram incubados a temp. amb. (25°C) em aquário com água salgada artificial, a qual foi preparada utilizado uma mistura de 46 g de NaCl, 22 g de MgCl2.6H2O, 8 g de Na2SO4, 2,6 g de CaCl2 ou CaCl2.6H2O, 1,4 g de KCl em 2000 mL de água dest. O pH foi ajustado para 9.0 usando Na2CO3 para evitar risco de morte das larvas por diminuição do pH durante a incubação. (LEWAN, 1992). Após 24 h da eclosão, foram preparadas soluções do óleo nas concentrações de 100, 50, 25, 10, 5 e 1 µg.mL-1, utilizando a água da salmoura como solvente e DMSO a 5% como dispersante. Em cada tubo com as sol. foram colocadas 10 larvas de A. salina e após 24 h foi calculada a taxa de mortalidade das larvas, com estimativa da conc. letal média (CL50).
RESULTADOS E DISCUSSÃO: DISCUSSÃO DOS RESULTADOS: O rendimento do óleo volátil (mg/100g) obtido foi de 3,0 % na amostra analisada. Foram identificados 48 constituintes representando de 100% do conteúdo total do óleo essencial, sendo o mesmo dominado por safrol (78,0%). A quantidade relativa de cada constituinte e seus respectivos índices de retenção está apresentada em tabela. Foi verificado para o óleo essencial que numa concentração acima de 50 µg.mL-1 havia uma taxa de mortalidade de 100% da população de larvas, portanto para o cálculo da CL50 foram utilizadas as concentrações compreendidas em o máximo e o mínimo de mortalidade, os valores dos percentuais foram convertidos para o método estatístico probitos (FINNEY, 1971), cujo valor encontrado para a CL50 é de 16,6 µg.mL-1.
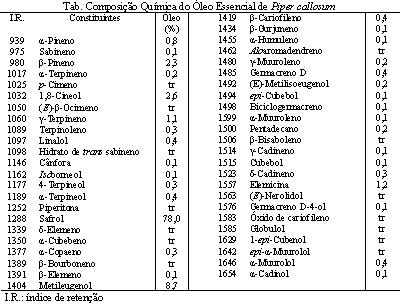
CONCLUSÕES: CONCLUSÃO: o exemplar de Piper callosum estudado apresentou alto teor de safrol nas folhas e galhos finos. As duas maiores aplicações para o safrol natural é a sua conversão química em piperonal e butóxido de piperonila. Em relaçãode toxicidade de extratos de planta através do bioensaio com A. salina, um valor de CL50 abaixo de 1000 µg.mL-1 é considerado como bioativo (MEYER, 1982). O óleo essencial apresentou CL50 < 1000 µg.mL-1; então, possui alta citoxicidade.
AGRADECIMENTOS: AGRADECIMENTOS: PPBIO/MCT.
REFERÊNCIAS BIBLIOGRÁFICA: REFERENCIAS:
ADAMS, R.P. 1995. Identification of Essential oil Components by Gas Chromatography/Mass Spectrometry. Allured Publ Corp., Carol Stream, IL, 469 pp.
ALBUQUERQUE, J.M.1989. Plantas medicinais de uso popular. Brasília, Associação Brasileira de Educação Agrícola Superior, 96p.
FINNEY D.J.: Probits analysis. 3ª ed. Cambridge University Press. 1971.
LEWAN L., ANDERSSON M., MORALES-GOMEZ P.: The use of Artemia salina in toxicity testing. Alternatives to Laboratory Animals. 20: 297-301, 1992.
MEYER, B.N., FERRIGNI N.R., PUTNAM J.E., JACOBSEN L.B., NICHOLS D.E., MC LAUGHLIN J.L.: Planta Medica. 45: 31-34, 1982.
VIEIRA, L.S. 1991. Manual da medicina popular: a ficoterapia da Amazônia. Belém, Faculdade de Ciências Agrárias do Pará, 248 p.
