ÁREA: Química Tecnológica
TÍTULO: AVALIAÇÃO DA QUALIDADE DAS CÁPSULAS DE CARBAMAZEPINA (CBZ) 200 MG
AUTORES: LIMA, R.A. (UFAL) ; NASCIMENTO, T.G. (UFAL) ; LEAL, F.H.S.G. (UFAL) ; ROCHA, V.N. (LIFAL) ; FRANÇA, D.M.M. (LIFAL)
RESUMO: RESUMO: O objetivo deste trabalho é avaliar a qualidade de cápsulas de carbamazepina 200mg através de dissolução e DSC produzidas por uma farmácia magistral de Maceió-AL. A formulação padronizada de carbamazepina 200mg foi comparada com formulações modificadas contendo carbamazepina e modificadores da solubilidade. Realizou-se estudo de compatibilidade carbamazepina-excipiente através da calorimetria exploratória diferencial (DSC) e avaliou-se as melhorias tecnológicas das formulações de carbamazepina por perfil de dissolução. Os dados de DSC mostraram que os excipientes utilizados na formulação na apresentam incompatibilidades físico-químicas com a carbamazepina. Os dados de dissolução mostraram que 2 formulações propostas apresentaram uma aumento de dissolução em relação a formulação padrão.
PALAVRAS CHAVES: palavras chaves: carbamazepina, dissolução, dsc.
INTRODUÇÃO: INTRODUÇÃO: A carbamazepina é quimicamente relacionada com os antidepressivos tricíclicos. Trata-se de um derivado de iminostilbeno com um grupamento carbamil na posição 5; essa molécula é fundamental para uma atividade anticonvulsivante potente (GILMAN, 2003). É um fármaco com baixa solubilidade em água sendo necessário técnicas para melhorar a quantidade de fármaco disponível nos fluidos gastrointestinal e consequentemente a sua absorção. A carbamazepina é um fármaco de baixo índice terapêutico (apresentam estreita margem de segurança, cuja dose terapêutica é próxima da tóxica), existe uma legislação vigente, a Resolução - RDC Nº. 354, de 18 de dezembro de 2003, a qual sujeita esses fármacos a ações de controle sanitário especial pelo órgão de vigilância sanitária (ANVISA). O segmento magistral atua em um setor de saúde extremamente competitivo e sensível, sob o controle de órgãos regulamentadores bastantes exigentes. Logo, a busca da qualidade dos produtos é especialmente importante, utilizando-se para isso das Boas Práticas de Manipulação (BPM) e da implantação do controle de qualidade,objetivando minimizar os riscos de sua manipulação, e assim não causando danos a saúde dos pacientes. O objetivo deste trabalho é avaliar a qualidade de cápsulas de carbamazepina 200mg através de dissolução e DSC produzidas por uma farmácia magistral de Maceió-AL.
MATERIAL E MÉTODOS: MATERIAIS E MÉTODOS: A formulação padrão (A) de carbamazepina foi manipulada na Farmácia Magistral A Fórmula no município de Maceió - Alagoas, de acordo com as Boas Práticas de Manipulação (BPM). As misturas binárias de carbamazepina e excipientes (amido, aerosil e estearato de magnésio) foram preparadas através da mistura física e homogenização em gral por 10 minutos. A formulação padrão, misturas ternárias e matéria-prima de carbamazepina foram submetidas a estudo de compatibilidade através da técnica térmica de DSC. As curvas DSC foram obtidas num calorímetro exploratório diferencial, modelo DSC 50, num fluxo de nitrogênio de 50ml.min.-1, razão de aquecimento de 10ºC.min -1, até a temperatura de 400ºC. A massa das amostras foram de 2,00 mg. Foram propostas duas formulações (B, C e D) modificadas tecnologicamente através de processo de dispersão sólida usando modificadores de solubilidade. As formulações foram avaliadas através do ensaio de dissolução. O teste de dissolução foi realizado num equipamento de dissolução da Erweka, gentilmente cedido pelo LIFAL (Laboratório Industrial Farmacêutico do Estado de Alagoas). O teste foi conduzido seguindo a metodologia da farmacopéia americana (USP - XXIV, 2000), no qual utilizou-se como meio de dissolução água destilada com Lauril Sulfato de Sódio a 1%,o aparato utilizado foi o de pá com velocidade de rotação de 75 rpm. Após coleta e diluição adequada as a percentagem de dissolução foi determinada por espectrofotometria em comprimento de onda de 288nm. A melhoria da qualidade das formulações foi verificada através do perfil de dissolução. Os perfil de dissolução da formulação padrão foi comparada as formulações modificadas.
RESULTADOS E DISCUSSÃO: RESULTADOS E DISCUSSÃO: A curva calorimétrica da CBZ mostrou três eventos endotérmicos nas temperatura de 171,66ºC, 191,00ºC e 264,58ºC, com calores de reação de -7,78 J/g, -97,49 J/g e -276,30 J/g. Na temperatura de 191,00ºC observou-se processo endotérmico correspondente a fusão da matéria-prima de carbamazepina (CBZ), enquanto o evento a 264,58ºC corresponde a decomposição. Na temperatura de 171,66ºC observa-se uma pequena transição de fase da matéria-prima. Este processo endotérmico sugere algum pico correspondente a polimorfismo da amostra. Segundo MCGREGOR (2004), a CBZ apresenta 4 formas polimorficas com as seguintes temperaturas de fusao: forma 1(191ºC), forma 2(80,73ºC), forma 3(174,4ºC) e forma 4(190,28ºC). Os dados de DSC foram analisados através sobreposição das curvas DSC da CBZ, seus excipientes, misturas ternárias e formulação padrão de CBZ. Os dados demonstram que os excipientes amido-aerosil não interferem com o fármaco na formulação. CBZ manteve o seu processo de fusão na temperatura de 191ºC, tanto na forma isolada (matéria-prima), quanto na forma de mistura demonstrando assim compatibilidade na mistura. A formulação padrão possui um perfil de dissolução melhor que a CBZ (matéria-prima), ou seja, a fórmula padrão atingiu uma percentagem de dissolução 25% maior que o fármaco. No período de tempo de 60minutos a formulação padrão atinge 73,54% de dissolução, enquanto a matéria-prima 46,66%. Estudos de dissolução das formulações tecnologicamente modificadas mostraram que a formulação D não apresentou melhorias no percentual de dissolução no tempo de 60 minutos em relação a formulação padrão. Porém, as formulações B e C mostraram um aumento no percentual de dissolução de 9,30% e 7,16%, respectivamente, em relação a formulação padrão (Figura 1).
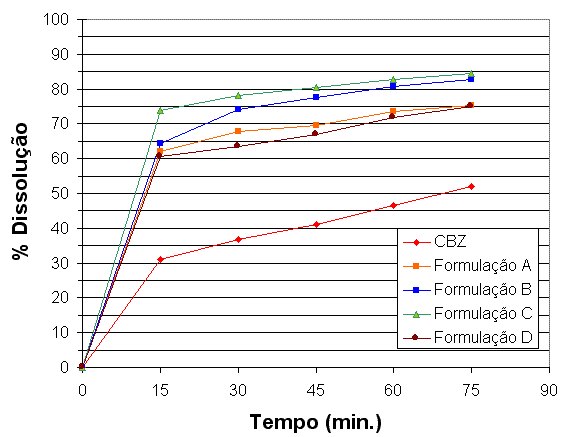
CONCLUSÕES: CONCLUSÕES: A qualidade da formulação padrão de carbamazepina manipulada por uma farmácia magistral de Maceió-AL apresenta-se dentro dos parâmetros de dissolução e adequada compatibilidade com os excipientes, porém novos estudos apresentados neste trabalho demostraram que é possível melhorar a disponibilização do fármaco em fluidos gástricos simulados aumentando assim, o processo de absorção de carbamazepina, considerado fármaco pobremente solúvel em água e consequentemente sua absorção.
AGRADECIMENTOS: AGRADECIMENTOS: Agradecemos ao Laboratório Industrial Farmacêutico de Alagoas (LIFAL) por permitir o uso dos equipamentos para execução dos testes de dissoluçã
REFERÊNCIAS BIBLIOGRÁFICA: REFERÊNCIAS BIBLIOGRÁFICAS: MCGREGOR, C.; SAUNDERS, M. H.; BUCKTON, G.; SAKLATVALA, R. D. 2004. The use of high-speed differential scanning calorimetry (Hyper-DSC-TM)to study the thermal properties of carbamazepine polymorphs, Thermochimica Acta, 417:231-237.
BRASIL. Agência Nacional de Vigilância Sanitária. RE nº 901, de 29 de maio de 2003. Guia para ensaios de dissolução para formas farmacêuticas sólidas orais de liberação imediata (FFSOLI). Diário Oficial da União, Brasília, 02 jun. 2003.
UNITED STATES PHARMACOPOEIA (USP). 24 ed. Rockville: The United States Pharmacopeial Convention, 2000.
GILMAN, A.G..; HARDMAN, J.G.; LIMBIRD, L.E., GOODMAN & GILMAN: As Bases Farmacológicas da Terapêutica, 10ª ed, Rio de Janeiro: McGraw-Hill, 2003.
