ÁREA: Química Orgânica
TÍTULO: RESOLUÇÃO DE PROFENOS: UM PROJETO PARA A DISCIPLINA QUÍMICA ORGÂNICA EXPERIMENTAL
AUTORES: ROMERO, A. L. (UNICAMP) ; MELLO, F. A. (UNICAMP) ; BAPTISTELLA, L. H. (UNICAMP) ; IMAMURA, P. M. (UNICAMP)
RESUMO: Nessa comunicação reportamos um projeto para ilustrar e exemplificar conceitos de estereoquímica, resolução de racematos e utilização de técnicas de RMN para identificação de compostos orgânicos, durante um curso de química orgânica experimental. Esse projeto envolve: a) extração do ibuprofeno e naproxeno de fármacos comerciais; b) resolução do ibuprofeno, via síntese de amidas diastereoisoméricas, utilizando (S)-(-)-a-metilbenzilamina; c) determinação estrutural dos compostos estudados por RMN; d) determinação da configuração absoluta das amidas diastereoisoméricas utilizando o modelo de Trost e por cromatografia gasosa.
PALAVRAS CHAVES: conceitos de estereoquímica, resolução de profenos, métodos cromatográficos e espectroscópicos.
INTRODUÇÃO: Historicamente, conceitos relacionados a estereoquímica de compostos orgânicos têm sido apontados como fonte de dificuldades, por alunos, em disciplinas de química orgânica durante a graduação (Baker, 1998). A consolidação desses conceitos pode ser conseguido através de atividades experimentais que ilustrem e permitam reflexões, assim como possibilite o desenvolvimento de temas ainda pouco explorados em sala de aula.
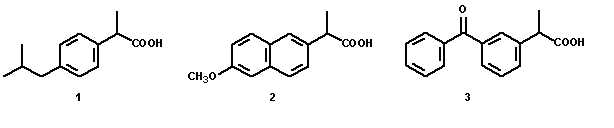
O trabalho com fármacos quirais se enquadra nas discussões acima, além de despertarem grande interesse por parte dos alunos. Entre os fármacos quirais de grande aplicabilidade encontram-se os profenos, antiinflamatórios derivados do ácido propiônico, cujo enantiômero in vitro mais potente é o (S)-(+), sendo, no entanto, vendidos comumente na forma racêmica. In vivo, os profenos sofrem racemização onde o enantiômero (R)-(-) é convertido em (S)-(+), numa proporção de 60% (Pinto, 2005). Os profenos de uso popular, no Brasil, são o ibuprofeno (1), naproxeno (2) e cetoprofeno (3), Figura 1.
Nessa comunicação reportamos um projeto de resolução de profenos através de um estudo cromatográfico e por ressonância magnética nuclear 1D e 2D das profenamidas obtidas. Esse projeto foi aplicado no 2º semestre de 2007 na disciplina de química orgânica experimental com alunos do curso de química da UNICAMP.
MATERIAL E MÉTODOS: Extração dos profenos de fármacos: o ibuprofeno (e o naproxeno) foi extraído de produtos comerciais através de procedimento convencional isto é, maceração, extração com solvente (AcOEt), filtração e evaporação do solvente.
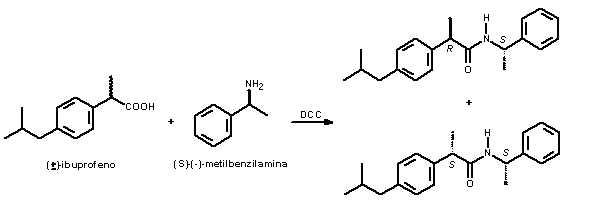
Preparação das ibuprofenamidas diastereoisoméricas: As amidas foram preparadas através da reação entre (±)-ibuprofeno (e naproxeno) e (S)-(-)-a-metilbenzilamina utilizando procedimento descrito por Trost (Trost, 1986).
Purificação das amidas por cromatografia de coluna: As amidas diastereoisoméricas (ibuprofenamidas) foram purificadas por CC de sílica gel e monitorada a separação por CCD.
RESULTADOS E DISCUSSÃO: Esse projeto foi iniciado, na primeira aula, com a extração concomitante dos fármacos antiinflamatórios ibuprofeno (Motrin® ou Uniprofen®, 600 mg/comprimido) e naproxeno (Naprosyn® ou Naprox, 250 mg/comprimido) utilizando acetato de etila. Os compostos extraídos, devidamente secos, tiveram suas propriedades físicas determinadas e comparadas com dados reportados na literatura. As propriedades físicas do ibuprofeno extraído de ambos os medicamentos, p.f. = 75-77ºC e [a]D = 0º (c = 1,0; EtOH), são concordantes com os dados da literatura para o racemato. Para o naproxeno, os dados físicos, p.f. = 155-157ºC e [a]D = + 66º (c = 1,0; EtOH), são concordantes para o enantiômero S puro. Na seqüência, esses profenos foram submetidos, separadamente, a derivatização com (S)-(-)-metilbenzilamina na presença de N,N-dicicloexilcarbodiimida (DCC), Figura 2.
Na segunda aula foi realizada a manipulação da reação (remoção da uréia e secagem do solvente) e estudo do perfil cromatográfico da reação por CCD (utilizando vários eluentes) e por cromatografia gasosa. Nessa etapa observou-se, como esperado, formação de dois diastereoisômeros na reação com o ibuprofeno (1) e apenas um produto na reação com o naproxeno (2). As profenamidas diastereoisoméricas foram separadas utilizando CC de sílica gel e obtidos os espectros de RMN 1D e 2D. O projeto permitiu ao aluno trabalhar com técnicas de RMN (1H, 13C, DEPT, COSY) para determinação estrutural (Sem, 1996), assim como determinação da configuração absoluta das amidas diastereoisoméricas utilizando o modelo de Trost (Trost, 1986) e dados de cromatografia gasosa (Paik, 2006). Estudo mais detalhado de RMN 1D e 2D permitiu fazer correção das atribuições de RMN de 1H encontrados na literatura (Sem, 1996).
CONCLUSÕES: Este projeto possibilitou o trabalho com diferentes conceitos de estereoquímica, assim como uma discussão sobre a comercialização de fármacos quirais na forma enantiomericamente pura e racêmica. A técnica RMN 2D se mostrou uma ferramenta muito útil para fazer atribuições correta dos dados de RMN de 1H.
AGRADECIMENTOS: Aos alunos do curso de química da UNICAMP que executaram o projeto.
REFERÊNCIAS BIBLIOGRÁFICA: Baker, R. W.; George, A. V.; Harding, M. M., J. Chem. Educ., 1998, 75, 853.
Christy, M. E., Ponticello, G. S., Varga, S. L., Springer, J. P., J. Org. Chem., 1986, 51, 2370.
Paik, M-J.; Lee, Y.; Goto, J.; Kim, K-R., J. Chromatogr. B, 2004, 803, 257-265.
Pinto, M. M. M., Boletim do CIM de set/out de 2005, disponível no endereço eletrônico: http://www.ordemfarmaceuticos.pt
Trost, B. M., Belletire, J.L., Godleski, S., McDougal, P.G., Balkovec, J.M., Baldwin, J. J., Christy, M. E., Ponticello, G. S., Varga, S. L., Springer, J. P., J. Org. Chem., 1986, 51, 2370.
Sem, S. E., Anliker, K. S., J. Chem. Educ., 1996, 73, 569.
