ÁREA: Química Orgânica
TÍTULO: SÍNTESE E ATIVIDADE FITOTÓXICA BIS(PIRIDIL)METANO DERIVADOS DA 4-HIDROXI-6-METILPIRIDIN-2-ONA.
AUTORES: VALENTE, V. M. M. (UFV) ; DEMUNER, A. J. (UFV) ; BARBOSA, L. C. A. (UFV) ; MAGALHAES, C. G. (UFV)
RESUMO: Diversos compostos bioativos apresentam o anel 6-metilpiridin-2-ona. Em função da atividade fitotóxica de piridionas como a gostatina e fluridona, foram sintetizados, com rendimentos de 35 a 92%, sete bis(piridil)metano derivados, sendo seis aromáticos com diferentes padrões de substituição. Esses compostos foram avaliados quanto ao potencial fitotóxico sobre o desenvolvimento radicular de sorgo (Sorghum bicolor), pepino (Cucumis sativus), corda-de viola (Ipomoea grandifolia) e brachiaria (Brachiaria decumbens) em teste de placa de Petri com areia lavada. Os derivados p-CNAr e m-NO2Ar causaram elevada inibição das espécies, sendo menos ativo contra B. decumbens, onde o p-CNAr induziu o crescimento radicular dessa espécie.
PALAVRAS CHAVES: piridionas, bis(piridil)metano, herbicidas
INTRODUÇÃO: O anel 6-metilpiridin-2-ona está presente na estrutura de diversos compostos de interesse farmacológico, como: anticancerígenos, antibióticos, cardiotônicos e anti-HIV (FINDLAY et al., 1978; ABADI et al., 1999; STORCK et al., 2005). Diversas piridionas são analgésica, antiinflamatória, fitotóxica (ÖZTÜRK et al., 2002), e outras, denominadas bis(piridil)metano, apresentam atividadeantitumoral (COCCO et al., 2003). São piridionas fitotóxicas: a fluridona que é um dos produtos mais utilizados no controle de plantas aquáticas (MACDONALD et al., 2008) e a gostatina, isolada de Streptomyces sumanensis (WAKABAYASHI et al., 2004).
Devido à escassez de trabalhos que relatem o preparo de compostos bis(piridil)metanos, considerando sua possível atividade herbicida, esse estudo tem como objetivo sintetizar tais compostos, visando detalhar a relação estrutura-atividade além da descoberta de novos compostos com potencial uso comercial. Utilizou-se assim, a 4-hidroxi-6-metilpiridin-2-ona, obtida a partir do ácido desidroacético, formaldeído e aldeídos aromáticos com diferentes padrões de substituição no anel.
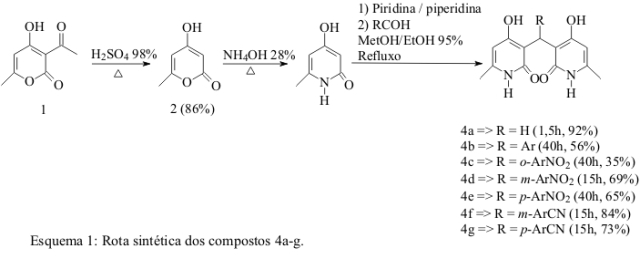
MATERIAL E MÉTODOS: Os compostos do tipo bis(piridil)metanos (esquema 1: 4a-g) foram obtidOs através da desacetilação do ácido desidroacético (1) com excesso de ácido sulfúrico a 130 °C. Em seguida foi feita a substituição do heteroátomo da lactona por nitrogênio, utilizando hidróxido de amônio em excesso a 100 °C (SETO et al., 1966). A reação de condensação da lactama (3), 4-hidroxi-6-metilpiridin-2-ona (1,5 mmol), com os diversos aldeídos (0,75 mmol), foi realizada utilizando-se quantidade catalítica de piperidina (15 x 10-6 L) em piridina (45 x 10-6 L) e uma mistura de etanol 95% e metanol como solventes (FINDLAY et al., 1976).
Todos os bis(piridil)metano derivado foram submetidos a ensaios de atividade fitotóxica sobre o desenvolvimento radicular de sorgo (Sorghum bicolor), pepino (Cucumis sativus), corda-de viola (Ipomoea grandifolia) e brachiaria (Brachiaria decumbens) em teste de placa de Petri com areia lavada. Foi utilizado como controle positivo o herbicida comercial diuron (D). Foram preparados 88 mL de solução na concentração de 0,5 mM (sendo 44 x 10-6 mol de amostra, 84 x 10-6 L de xileno, 127 x 10-6 L de Tween 80, 42 x 10-6 L de pentan-3-ona em água destilada) para 660 g de areia, que foram distribuídas em quatro placas, onde foram colocas as sementes previamente germinadas. As medidas de comprimento radicular foram efetuadas após 24 e 48h. As porcentagens de inibição foram calculadas em relação aos experimentos controle (a solução sem bis(piridil)metano) e os resultados estão representados na figura 1.
RESULTADOS E DISCUSSÃO: De acordo com FINDLAY et al. (1976) os rendimentos da reação entre a 4-hidroxi-6-metilpiridin-2-ona com aldeídos são elevados, sendo que a velocidade da reação para o formaldeído é muito superior à dos demais. Da mesma forma a condensação da lactama (3) com os aldeídos levou aos compostos bis(piridil)metano (4a-g) com rendimentos que variaram de 35% a 92% (Esquema 1). O baixo rendimento obtido na reação com o-Nitrobenzaldeído, certamente está relacionado ao impedimento estérico causado pelo grupo nitro. Isto dificulta o ataque nucleofílico à carbonila do referido aldeído, bem como a adição de Michael, que ocorre após a desidratação do álcool formado deste ataque nucleofílico, reduzindo significativamente a velocidade e consequentemente, o rendimento desta reação.
A simples substituição de um hidrogênio de 4a pelo anel aromático não causa alteração significativa na atividade fitotóxica (figura 1). Porém, quando esta substituição é feita por um anel aromático orto, meta ou para-substituído, observam-se mudanças no padrão de inibição causado por 4a. Comparando-se os substituintes aromáticos, quando o grupo nitro está na posição meta, o bis(piridil)metano é mais ativo em comparação ao nitro em orto e para. O mesmo não acontece quando o substituinte é o grupo ciano. Neste caso, o bis(piridil)metano é ligeiramente mais ativo quando este substituinte encontra-se na posição para. Entretanto, os dois bis(piridil)metano ciano substituídos apresentam o mesmo padrão de inibição frente as quatro espécies estudas.
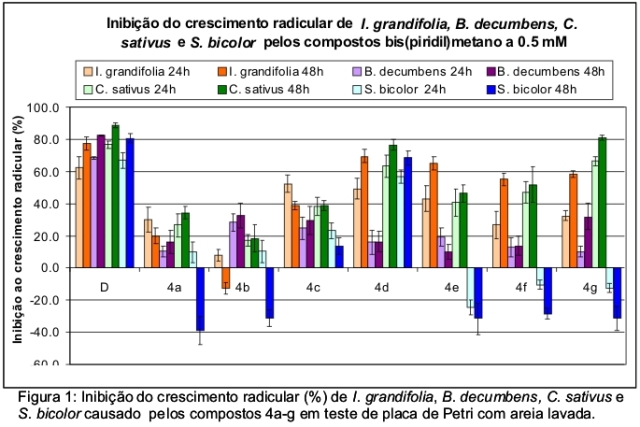
CONCLUSÕES: A obtenção destes bis(piridil)metanos, feita através de uma rota sintética muito simples, proporcionou elevados rendimentos de compostos com potencial uso herbicida. O derivado p-CNAr, além de apresentar atividade comparável ao herbicida comercial diuron, contra pepino, mostrou-se seletivo ao sorgo. Por sua vez, o composto m-NO2Ar causou inibição de todas as quatro espécies, sendo menos expressivo contra B. decumbens, e comparáveis ao diuron para os demais.
AGRADECIMENTOS: À Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq)
REFERÊNCIAS BIBLIOGRÁFICA: ABADI, A.; AL-DEEB, O.; AL-AFIFY, A.; EL-KASHEF, H. Synthesis of 4-alkyl (aryl)-6-aryl-3-cyano-2(1H)-pyridinones and their 2-imino isosteres as nonsteroidal cardiotonic agents. Il Farmaco, v. 54, p. 195–201, 1999.
COCCO, M. T.; CONGIU, C.; ONNIS, V. New bis(pyridyl)methane derivatives from 4-hydroxy-2-pyridones: synthesis and antitumoral activity. European Journal of Medicinal Chemistry, v. 38, p. 37-47, 2003.
FINDLAY, J. A.; KREPINSKY, J.; SHUM, F. Y.; TAM, W. H. J. Reactions of 4-hydroxy-6-methyl-2-pyridone with aldehydes. CAN. J. CHEM., v. 54, p. 270-274, 1976.
FINDLAY, J. A.; TAM, W. H. J.; KREPINSKY, J. The chemistry of some 6-methyl-4-hydroxy-2-pyridones. CAN. J. CHEM., v. 56, p. 613-616, 1978.
MACDONALD, G. E.; PURI, A.; SHILLINGET, D. G. Interactive Effect of Photoperiod and Fluridone on Growth, Reproduction, and Biochemistry of Dioecious Hydrilla (Hydrilla verticillata). Weed Science, v. 56, p. 189-195, 2008.
ÖZTÜRK, G.; EROL, D. D.; AYTEMIR, M. D.; UZBAY, T. New analgesic and antiinflammatory agents 4(1H)-pyridinone derivatives. European Journal of Medicinal Chemistry, V. 37, p. 829-834, 2002.
SETO, S.; SASAKI, H.; OGURA, K. The reaction of aminotropones with diketene.II. The structure of by-product in the reaction of 5-aminotropolone with diketene. Bulletin of the Chemical Society of Japan, v.39, n.2, p.281-285, 1966.
STORCK, P.; AUBERTIN, A.; GRIERSON, D. S. Tosylation/mesylation of 4-hydroxy-3-nitro-2-pyridinones as an activation step in the construction of dihydropyrido[3,4-b]benzo[f ][1,4]thiazepin-1-one based anti-HIV agents. Tetrahedron Letters, v. 46, p. 2919–2922, 2005.
WAKABAYASHI, K.; BÖGER, P. Phytotoxic sites of action for molecular design of modern herbicides (Part 2): Amino acid, lipid and cell wall biosynthesis, and other targets for future herbicides. Weed Biology and Management, v. 4, 59–70, 2004.
