ÁREA: Bioquímica e Biotecnologia
TÍTULO: INATIVAÇÃO FOTODINÂMICA DE MACRÓFAGOS DE CAMUNDONGO SWISS UTILIZANDO A FTALOCIANINA DE ALUMÍNIO COMO FOTOSSENSITIZADOR
AUTORES: GARCES, B.P (UFU) ; FRANÇA, E.G (UFU) ; OLIVEIRA, C.A (UFU) ; PAULA, L.F (UFU) ; MARTINS, J.F.N (UFU) ; SANTOS, R.O (UFU) ; COSTA, T.O (UFU) ; CEOLIN, M.P (UFU) ; SOUZA, G.D (UFU) ; NETO, A.D.A (UFU) ; FERREIRA, F.S (UFU)
RESUMO: Neste trabalho, quantificamos a morte celular causada pela ação da Inativação Fotodinâmica (PDI) em macrófagos peritoneais de camundongo swiss da espécie Mus muscullus. Foi utilizado como fotossensitizador a ftalocianina de Alumínio encapsulada em lipossomas unilamelares de 100 nm. A emissão de luz foi efetuada por LED(Light Emissor Diods) em um comprimento de onda de aproximadamente 640 nm, ativando o fotossensitizador e com isso produzindo oxigênio “singlet”. Acreditamos que a Inativação Fotodinâmica realizada de forma eficiente pode representar os mesmos resultados de uma Terapia Fotodinâmica que é atualmente bastante utilizada em várias áreas de conhecimento, como química, medicina, estética, biomedicina, oncologia, biologia celular e cirurgia vascular.
PALAVRAS CHAVES: terapia fotodinâmica inativação
INTRODUÇÃO: Terapia Fotodinâmica é o processo de morte celular fotoinduzida pela utilização de um fotossensitizador, da luz e do oxigênio presente no ambiente.
A luz em um comprimento de onda específico de aproximadamente 640 nm excita o fotossen-sitizador que pula para um estado “triplet” que possui muita energia, ao voltar para o estado normal esse fotossensitizador libera a energia para o meio, esta energia é absorvida pelo oxigênio molecular que vai para o estado “singlet”.
O oxigênio “singlet” é uma espécie reativa de oxigênio(ROS) extremamente reativa, sua meia vida é de aproximadamente 10-5s, o que faz com que ele reaja facilmente com moléculas no organismo, causando a morte celular por necrose ou apoptose.
A utilização de macrófagos de camundongo para estudo da viabilização da PDI foi feita porque é uma célula que se adere facilmente em lamínulas, e com isso a quantificação é mais eficiente.
O macrófago é uma célula do sistema imune responsável pela fagocitose de agente externos, por isso ela absorve as lipossomas com o AlHPc que ao ser excitada inativa a célula. A terapia fotodinâmica é provavelmente a alternativa mais viável para uma potencial cura de câncer de várias formas. Já é utilizado em câncer de pele.
MATERIAL E MÉTODOS: Produção e coleta de macrófagos:
Os macrófagos foram retirados de camundongos Swiss da espécie Mus muscullus.
Para estimular a produção de macrófagos, foi injetado 0,5 mL de Zymosan + Adjuvante de Freund’s na cavidade peritoneal.
Cinco dias depois os camundongos foram executados e retirou-se os macrófagos da cavidade peritoneal juntamente com 10 mL de Alsever e as células foram mantidas em gelo.
Contagem das Células:
Antes de realizar a PDI, as células foram contadas em Câmara de Newbauer, utilizando o teste de exclusão de azul de Trypan para analisar a porcentagem de células vivas no início do experimento.
Preparação das lamínulas com macrófagos:
Foi colocada sobre as lamínulaas a solução de Alsever com os macrófagos para se aderirem durante 20 minutos, em seguida as lamínulas foram lavadas por imersão 10 vezes para a retirada dos linfócitos presentes na solução, que não aderem à lamínula.
Colocou-se sobre as lamínulas 2 mL de ftalocianina de Alumínio encapsulada em lipossomas, deixando por 20 minutos.
PDI dos Macrófagos:
A PDI foi feita utilizando um sistema com LED’s emissores de luz a um comprimento de on-da de 640 nm. As lamínulas com os macrófagos e o fotossensitizador foram colocadas a uma distância aproximada de 30 cm da fonte emissora de luz.
A irradiação luminosa foi feita durante 5 minutos.
RESULTADOS E DISCUSSÃO: Com esta metodologia, obtivemos aproximadamente 60% de morte celular dos macrófagos que estavam como fotossensitizador e na presença de luz vermelha.
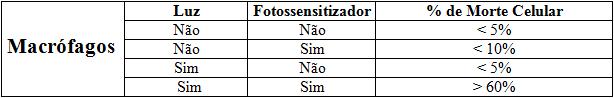
CONCLUSÕES: Conclui-se que a inativação fotodinâmica ocorre de forma eficaz quando se coloca juntamente com as células o fotossensitizador e com uma emissão de luz a um comprimento específico (comprimento de onda por volta de 640 nm).
Apesar dos resultados ainda serem preliminares, acreditamos que a concentração do fotossensitizador, o tempo de exposição à luz e o tempo de incubação. Próximos testes serão realiza-dos com diferentes fotossensitizadores, concentrações, tempos de irradiação e tempo de incubação das células com o fotossensitizador.
AGRADECIMENTOS: Agradecemos a todos que permitiram a realização desse trabalho.
Ao Instituto de Genética e Bioquímica da Universidade Federal de Uberlândia.
REFERÊNCIAS BIBLIOGRÁFICA: 1- Borra, C.and Miquel, J. (2007 ) IUBMB Life, 59: 249 – 254;
2- Ruggiero, R.; Castellan, A.; Silva, L G (2007) . J. Photochem. Photobio. v. 190, p. 110-120
3- Oliveira, et. al (2005) Chem. Phis. Lipids , v. 113, p. 69-78
