ÁREA: Química Inorgânica
TÍTULO: Influência da %p e %s na acidez de alguns Compostos Orgânicos.
AUTORES: LIMA,E.C.A.(IC) (UFRN) ; FELIPE,A.(IC) (UFRN) ; SILVA,A.O.(PQ) (UFRN) ; LIMA,F.J.S.(PQ) (UFRN)
RESUMO: O estudo aprofundado sobre hibridização existe desde meados do século XX, mas até os dias atuais pouco sabemos deste imenso universo tão pouco explorado. Neste trabalho foi demonstrado de maneira objetiva e concisa, como a variação de ângulos nas moléculas e a porcentagem dos orbitais s e p influenciam na acidez de alguns compostos orgânicos haloalcanos. Para tais demonstrações foram utilizados métodos simples de cálculos de parâmetros de hibridização e percentuais de orbitais s e p, com os quais determinou-se valores variados para cada molécula, segundo sua estrutura, e concluiu-se que as %s e %p na formação de um híbrido depende do ângulo de ligação entre os átomos de uma molécula, sendo esses parâmetros importante para explicação de algumas estruturas moleculares e propriedades químicas
PALAVRAS CHAVES: hibridização, acidez, haloalcanos
INTRODUÇÃO: Os haloalcanos (também denominados haletos de alquila) correspondem ao grupo de compostos pertencentes à função orgânica derivados halogenados, obtidos pela halogenação de alcanos como o metano e o etano. De acordo com as teorias de acidez e basicidade(HUHEEY, J. E,1978), observa-se que a acidez dos haletos decresce do flúor para o iodo (F- < Cl- < Br- < I- ), sabendo-se que o flúor apresenta maior basicidade, investigou-se os índices de hibridização de alguns haloalcanos contendo o elemento em sua composição, observando-se como a proporção deste, nos compostos orgânicos pode influenciar na acidez dos mesmos .
MATERIAL E MÉTODOS: As hibridizações mais comuns que envolvem orbitais do tipo s e p são aquelas em que os ângulos @ij (90º < @ij < 180º) entre os híbridos valem 180º, 120º e 109º28'. Nestas situações, (NASCIMENTO, A. B., BRITO, W. N. e SÁ, A. J. S. L,1987) as repulsões entre os pares de elétrons ficam bastante minimizadas já que os orbitais híbridos nas direções i,j são equivalentes. No entanto, em alguns compostos, os ângulos de ligação se afastam um pouco dos acima citados, implicando com isto, uma hibridização "um pouco diferente" das corriqueiramente conhecidas (sp, sp2, sp3).
Nos casos comuns de hibridização envolvendo orbitais s e p, temos:
onde: @= Teta e /\= Lambda
1 + /\i/\jcos@ij = 0 (I)
sabendo-se que /\i e /\j são parâmetros que determinam as porcentagens relativas de s e p, e q é o ângulo formado pela ligação entre as espécies químicas e temos a relação 90º < @ij < 180º. Quando i = j obtemos:
1 + /\ii2cos@ = 0 (II)
As porcentagens de s e p são calculadas de acordo com as relações:
%s no híbrido = 1 / (1 + /\2) * 100% = cos@ / cos@-1 * 100% (III)
%p no híbrido = /\2 / (1 + /\2) * 100% = 1 / cos@1 * 100% (IV)
/\2 pode então ser definido como:
/\2 = (%p no híbrido) / (%s no híbrido) (V)
Com o uso destas equações e com base nos ângulos de ligações determinou-se os percentuais dos orbitais s e p, o parâmetro de hibridização e a hibridização das moléculas de Fluorometano (CH3F), Difluorometano (CH2F2) e de Trifluorometano (CHF3).
RESULTADOS E DISCUSSÃO: Nas tabelas abaixo estão os parâmetros de hibridização dos compostos flouroalcanos: Fluorometano (CH3F), Difluorometano (CH2F2) e de Trifluorometano (CHF3)(GREENWOOD,1984):
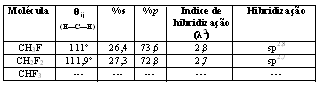
Para o ângulo formado entre as ligações H—C—H:
*(tabela em anexo)
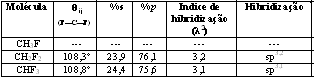
Para o ângulo formado entre as ligações F—C—F:
*(tabela em anexo)
Analisando-se a hibridização acima se observa que nestes compostos com o aumento da contribuição do orbital p, aumenta-se a acidez, ficando esta na seguinte ordem:
CH3F > CH2F2 >CHF3
Isso também pode ser explicado de acordo com a eletronegatividade do flúor que por atrair os elétrons para si, dificultando a liberação de prótons pela molécula, neste caso, quanto maior o número de átomos de flúor na molécula, menor será sua acidez.Desta forma, podemos observar que este fator é bastante significativo para a determinação qualitativa de parâmetros de acidez dos compostos.
CONCLUSÕES: Levando-se em consideração o conceito de hibridização e a importância dos orbitais híbridos no estudo das propriedades químicas dos compostos, conclui-se que o aumento na contribuição dos orbitais s e p resulta em uma variação na acidez dos compostos de alcanos fluorados.
AGRADECIMENTOS: A Pró- reitoria de graduação- PROGRAD pelo incentivo .
REFERÊNCIAS BIBLIOGRÁFICA: HUHEEY, J. E. Química Inorgánica: Principios de estructura y reactividad. México: Harla, 1978.
GREENWOOD, N. N. and EARNSHAW, A. Chemistry of the Elements. U.S.A: Pergamon Press, 1984.
NASCIMENTO, A. B., BRITO, W. N. e SÁ, A. J. S. L. Acerca do Índice de Hibridização do Carbono Com Algumas Aplicações Práticas. UFPB-Paraíba: Publicações Internas, 1987.
