ÁREA: Química Inorgânica
TÍTULO: Estudo da coordenação da treonina com o íon cobre(II)
AUTORES: SILVA, A. M. (CEFETQUÍMICA) ; MORAES, R. S. (CEFETQUÍMICA) ; SANTOS, C. M. (CEFETQUÍMICA) ; NOGUEIRA, V. S. (CEFETQUÍMICA) ; FELCMAN, J. (PUC-RIO)
RESUMO: O íon cobre(II) está presente no fluido biológico, podendo coordenar-se com moléculas biologicamente ativas. Existem, porém, formas variadas do íon cobre interagir com as moléculas, pois essas apresentam diferentes sítios onde pode ocorrer a coordenação. A identificação desses sítios de coordenação, em solução, permite melhor avaliar a função ou efeito desse íon no organismo e sugerir formas de potencializar ou inibir a sua atuação. A treonina é um aminoácido que possui três potenciais sítios de coordenação, podendo atuar como ligante mono, bi ou tridentado. Através dos dados obtidos por espectroscopia UV-Vis e titulação potenciométrica foi possível avaliar a participação dos átomos que atuam na coordenação e a estabilidade dos complexos formados entre a treonina e o íon cobre(II).
PALAVRAS CHAVES: cobre(ii), compostos de coordenação, treonina
INTRODUÇÃO: Uma dificuldade na exata caracterização de complexos in vivo é causada pela existência de centenas de ligantes competindo por vários íons ao mesmo tempo. Outra dificuldade é a existência, in vivo, de macromoléculas com vários grupos doadores tornando o estudo das interações e competições extremamente complicado. Considerando-se a complexidade dos sistemas biológicos, busca-se simular ou reproduzir de forma parcial ou total o seu comportamento químico, trabalhando-se com sistemas mais simples. A análise de modelos tem, em muitos casos, servido para elucidar os mecanismos nos quais ocorrem muitos processos biológicos fundamentais e a estrutura de vários sistemas metálicos presentes nos seres vivos. De todos os modelos possíveis de sistemas envolvendo íons metálicos e ligantes biologicamente importantes, os relacionados à interação metal-aminoácido têm sido os estudados há mais tempo e mais intensivamente (1). A razão está no fato das proteínas conterem o mesmo tipo de átomos doadores e os aminoácidos podem, então, servir como um modelo simples para as reações metal-proteína e também para os sistemas biológicos nos quais as propriedades das proteínas são modificadas por terem íons metálicos a elas ligados. Em aminoácidos que possuem um terceiro potencial sítio de coordenação não é conclusivo, em muitos casos, se estes sítios participam ou não da coordenação. A participação de mais um sítio na coordenação implica na formação de um complexo mais estável que pode melhorar ou prejudicar a absorção desse íon pelo organismo. Várias técnicas podem auxiliar na avaliação dos sítios de coordenação que participam efetivam na complexação de um íon, entre elas a espectroscopia de UV-Visível (2, 3, 4), através dos espectros obtidos com varredura de pH e a titulação potenciométrica (5), com a determinação das constantes de estabilidade dos complexos.
MATERIAL E MÉTODOS: (a) Estudo espectrofotométrico
O estudo espectrofotométrico foi realizado com varredura automática de 200 a 800 nm, do sistema binário cobre:treonina (Cu:Thr) em diferentes proporções (1:1, 1:2, 1:3). Foram utilizados 10,00 mL de KNO3 1,20 mol.L-1 para manter a força iônica constante, 10,00 mL da solução de cobre 10-2 mol.L-1 preparada a partir do CuSO4.5H2O e 100,00 mL da solução do ligante em diferentes concentrações (1,00.10-3, 2,00.10-3 e 3,00.10-3 mol.L-1). Trabalhou-se na temperatura de 25°C e o pH foi variado com a adição de KOH. Os valores de pH da solução, para cada alíquota retirada, foram registrados. A água destilada foi usada como branco em todos os sistemas. Foi utilizado o espectrofotômetro UV-Visível da marca Varian-Cary 50Conc.
(b) Estudo de estabilidade
Foram realizadas titulações potenciométricas dos ligantes puros e dos sistemas metal-ligante em condições experimentais semelhantes ao estudo espectrofotométrico. Os dados coletados foram utilizados no programa HYPERQUAD, para o refinamento das constantes de estabilidades das espécies. As constantes de estabilidades obtidas com o programa HYPERQUAD foram colocadas no programa HYSS2006 para a obtenção da curvas de distribuição de espécies em função do pH. Foram utilizados bureta automática (Schott Gerate- modelo T80/20), pHmetro (Tecnal- modelo Tec-3MP), agitador automático (Fisatom- modelo 752 A) e eletrodos de vidro combinado Ag/AgCl.
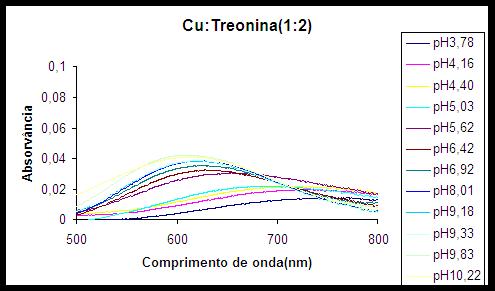
RESULTADOS E DISCUSSÃO: Através da espectroscopia no UV-Vis foi possível avaliar em que pH ocorre a a participação do átomo de nitrogênio na coordenação do íon cobre. Foram analisados os espectros obtidos em valores variados de pH, nas proporções metal:ligante, 1:1, 1:2 e 1:3. Inicialmente a coordenação do íon cobre(II) ocorre apenas com os átomos de oxigênio da água; posteriormente, com o oxigênio do grupo carboxilato e, em valores de pH mais altos, ocorre a coordenação com o nitrogênio do grupo amino, o que fica evidenciado pelo aumento da absortividade molar e a diminuição do comprimento de onda máximo. Esse comportamento é ilustrado na figura 1. Os espectros obtidos na proporção metal:ligante 1:3 apresentam comportamento muito semelhante ao observado na proporção 1:2, sugerindo que a coordenação ocorre da mesma forma e com o mesmo número de moléculas de ligante da proporção 1:2.
Foram obtidos valores de constantes de estabilidade através dos dados potenciométricos, entre eles: HL= 9,01 (8,97), H2L= 11,78 (11,17), ML= 8,03 (7,98), MHL= 11,37, MLOH= 1,05, ML(OH)2= -9,29, ML2= 14,82 (14,66), ML2OH= 5,89, ML2(OH)2= -4,34 e o valor de ML3 não foi possível determinar (entre parênteses são apresentados valores da literatura).
Com os valores obtidos das constantes foram traçadas as curvas de distribuição de espécies em função do pH, onde é possível avaliar a zona de predominância das espécies. Na figura 2, é apresentada a curva para a proporção metal:ligante 1:2. Comparando-se as figuras apresentadas, percebe-se que a partir do pH onde começa a predominar a espécie ML2, pH~6,5 (figura 2) é onde há um grande deslocamento da banda d-d para valores de maior energia e este valor permanece praticamente constante (figura 1), mostrando que a partir desse momento a coordenação pelo átomo de nitrogênio é efetivada mesmo ocorrendo posterior hidrólise dessa espécie.
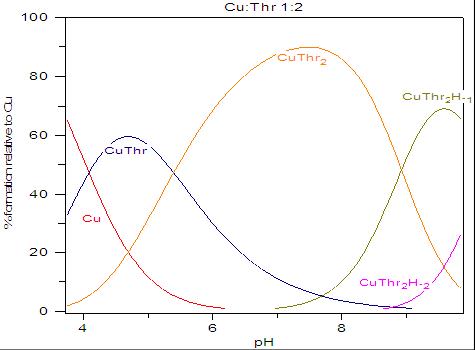
CONCLUSÕES: A análise dos espectros obtidos em torno do pH 7,40 indica que a espécie predominante na proporção metal:ligante 1:1 é a ML, com a coordenação clássica dos aminoácidos. Na proporção metal-ligante 1:2, ocorre a formação da espécie ML2 com a participação de dois átomos de nitrogênio, na coordenação do íon cobre, um de cada molécula do ligante, provocando um deslocamento da banda d-d para comprimentos de onda mais baixos e maior valor da absortividade molar. No entanto, os dados espectroscópicos e de estabilidade não indicam a formação do complexo ML3 na proporção metal-ligante 1:3.
AGRADECIMENTOS: CNPq
CEFET Química-RJ
REFERÊNCIAS BIBLIOGRÁFICA: (1) KISS, T. Biocoordination Chemistry. Kálmán Burger (Ed.). Nova York: Ellis Horwood, 1990.
(2) KOZLOWSKI, H.; MICERA, G. Handbook of Metal-Ligand Interactions in Biological Fluids. Ed. Guy Berthon, Vol.1, 1995. p. 566-581.
(3) MACCARRONE, G. et al., Thermochim. Acta. 362, p. 13-23, 2000.
(4) SILVA, A. M. et al. Polyhedron, v. 25, n. 6, p. 1319-1326, 2006.
(5) GANS, P. et al. Coord. Chem. Rev., 184, p. 311-318. 1999.
