ÁREA: Ambiental
TÍTULO: Comparação das rotas metílica e etílica para obtenção de biodiesel através da transesterificação do óleo de soja via catálise básica
AUTORES: OLIVEIRA, E.V.A (UERJ) ; THOMAZ, D. (UERJ) ; MARIA, L.C.S (UERJ)
RESUMO: O biodiesel é um combustível biodegradável obtido a partir de fontes renováveis que surgiu como uma alternativa para minimizar a importação do petróleo e impactos ambientais.O óleo vegetal ou gordura animal reage com o álcool (1/3) na presença de base ou ácido forte, produzindo uma mistura de ésteres de ácidos graxos (biodiesel) e glicerol. Esse trabalho estuda a conversão do óleo de soja via rotas metílica e etílica para produção de ésteres, usando razão molar álcool/óleo=6/1, variando as quantidades do catalisador(KOH), temperatura reacional e tipo de álcool. Os resultados da rota metílica foram comparados aos obtidos pela rota etílica e analisados por FT-IR. Os melhores rendimentos foram obtidos com a utilização do metanol em temperatura ambiente e 0,5% a 1,0% de catalisador.
PALAVRAS CHAVES: biodiesel, álcoois, óleo de soja
INTRODUÇÃO: O biodiesel é uma mistura de ésteres metílicos ou etílicos de ácidos graxos que pode ser obtido através do processo de craqueamento (pirólise) ou transesterificação. Por ser um combustível biodegradável, ambientalmente correto e economicamente competitivo devido à utilização de fontes renováveis de matéria-prima (óleos vegetais e gorduras animais) e catalisadores de baixo custo (Geris et al., 2007), tem adquirido espaço no mercado nacional e internacional. A transesterificação é o processo de conversão de triglicerídeos em ésteres de ácidos graxos e glicerina, por meio de reações com álcoois, em presença de um catalisador ácido ou básico. É uma reação reversível, sendo necessário excesso de álcool para favorecer a formação dos produtos desejados. A estequiometria da reação é de 3/1 (álcool/lipídeo), porém na prática, usa-se a relação de 6/1 para aumentar a geração do produto. A espécie da oleaginosa, a razão molar, o tempo de reação, o álcool e o catalisador utilizados são fatores cruciais para se obter um bom rendimento. A catálise básica é normalmente mais usada por razões econômicas, de disponibilidade dos catalisadores (hidróxidos de sódio e potássio), por ser mais rápida e apresentar melhor rendimento que a ácida (Ferrari et al., 2004). Em relação ao álcool, o metanol é o mais usado na transesterificação por razões de natureza física e química (cadeia curta e polaridade). No entanto, o etanol é mais popular, por ser renovável e muito menos tóxico que o metanol (Kitakawa et al., 2007). Assim, o presente trabalho tem como objetivo realizar um estudo comparativo do desempenho do metanol e etanol na reação de transesterificação do óleo de soja via catálise básica, variando a quantidade do catalisador hidróxido de potássio e a temperatura do sistema reacional.
MATERIAL E MÉTODOS: Num reator equipado com motor de agitação mecânica e condensador de refluxo, adicionaram-se o álcool e o hidróxido de potássio. Ao ocorrer a dissolução total do hidróxido no álcool, adicionou-se o óleo de soja na razão molar álcool/óleo de 6/1. Manteve-se o sistema sob agitação mecânica em temperatura ambiente por 60 minutos. Ao cessar a reação, transferiu-se o conteúdo do balão para uma ampola de separação e aguardou-se a completa separação de fases em 24 horas. Separadas as fases éster e glicerol, lavou-se a fase esterificada com 100 mL de HCl 0,1 M. Foi acrescentada à fase orgânica uma pequena porção de cloreto de sódio, deixando-se repousar por 24 horas. Por fim, filtrou-se e armazenou-se a fração esterificada em frasco limpo, seco e lacrado. Realizaram-se as reações modificando a quantidade de catalisador na proporção de 0,3; 0,5; 0,8; 1,0 e 1,5 g, o álcool (metanol ou etanol) e a temperatura (ambiente e 50°C).
Executaram-se também análises no espectrofotômetro de infravermelho, (FTIR Perkin Elmer Spectrum One) resolução 4cm-1, faixa de 4000 cm-1 a 450 cm-1, para caracterização do óleo de soja e da fase esterificada ou biodiesel.
RESULTADOS E DISCUSSÃO: O excesso dos álcoois metanol e etanol anidro fsvoreceu a produção da fração biodiesel. Foram testadas quantidades de hidróxido de potássio, à temperatura ambiente e a 50°C, usando metanol ou etanol e sob agitação constante por 60 min. Os rendimentos dos ésteres obtidos foram satisfatórios e dependentes das percentagens do catalisador(Figura 1). O maior rendimento em ésteres obtidos foi pela rota metílica(94%), com 0,5% de KOH e a temperatura ambiente. Houve decréscimo deste percentual ao aumentar a temperatura, devido à provável decomposição do produto. A melhor percentagem de catalisador para rendimentos acima de 90% foi 0,5% a 1,0% e a pior 1,6% (75,9%). A reação com etanol, à temperatura ambiente, teve menor rendimento que com metanol. O máximo atingido foi 88% de ésteres etílicos, usando 1% de catalisador e temperatura a 25°C. Na temperatura de 50°C, os rendimentos da fase esterificada pela rota metílica diminuíram atingindo o máximo de 92,9% com 0,62% de KOH e mínimo de 61,5 % com 0,3% KOH. As reações com 0,3%, 1,0% e 1,6% de catalisador e etanol não apresentaram separação de fases, e outras obtiveram rendimentos baixos. Na análise por FTIR detectou-se apenas a diferença nos espectros entre o óleo de soja e os ésteres (metílicos ou etílicos), independente da rota seguida (Figura 2). Os espectros dos produtos obtidos pela rota metílica e etílica foram iguais. A faixa 3471 cm-1 refere-se à vibração de estiramento da ligação O-H de hidroxilas de ácidos carboxílicos livres ou de traços de água de intensidade fraca, indicando o baixo teor no óleo e ésteres. A região 1459-1436cm-1 refere-se à deformação angular simétrica do grupo metileno(δsCH2) da cadeia do éster e a 1196-1143cm-1 atribuí-se às vibrações de estiramento assimétricos acoplados de C-O(νasC-O) dos ésteres.
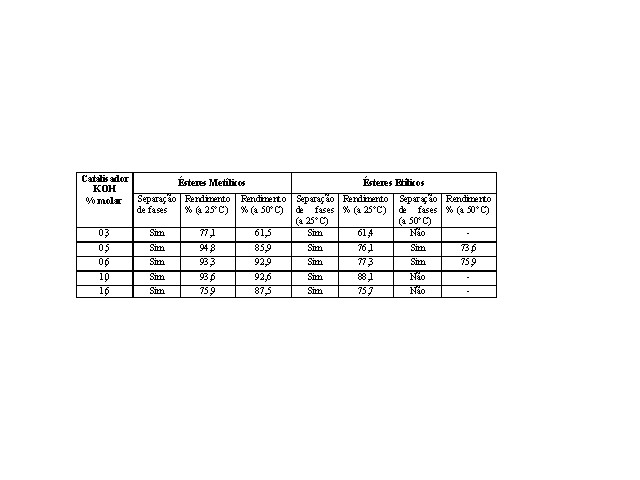
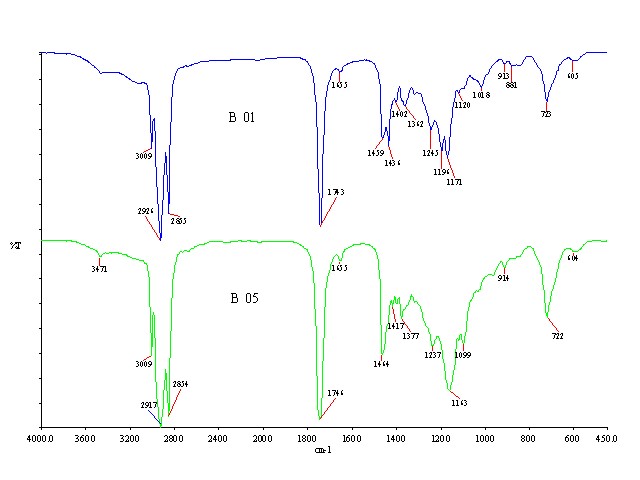
CONCLUSÕES: Por meio desse estudo realizado comprovou-se que a transesterificação via catálise homogênea básica pela rota metílica à temperatura ambiente apresentou um melhor rendimento (94%) quando comparado à rota etílica. Já que o etanol, apesar de mais barato e menos tóxico, é mais higroscópico. A água presente no etanol interfere na reação, reduzindo a quantidade de produto transesterificado e propicia a formação de emulsão na mistura dos ésteres devido à saponificação do óleo vegetal. A análise de FTIR permitiu a diferenciação da matéria-prima do produto final e identificação do biodiesel.
AGRADECIMENTOS: Aos técnicos do Laboratório de Tecnologia Ambiental da UERJ
REFERÊNCIAS BIBLIOGRÁFICA: FERRARI, R.A.; OLIVEIRA, V. S.; SCABIO, A.2005. Biodiesel de soja – taxa de conversão em ésteres etílicos, caracterização físico-química e consumo em gerador de energia. Química Nova,28: 19-232.
GERIS, R.; SANTOS, N.A.C.; CARVALHO, J.R.M.2007. Biodiesel de soja – reação de transesterificação para aulas práticas de química orgânica. Química Nova,30: 1369.
KITAKAWA, N.S.; HONDA, H.; KURIAYASHI, H.; TODA, T.; FUKUMURA, T.; YONEMOTO, T. 2007. Biodiesel Prodution usin anionic íon-exchange resin as heterogeneous catalyst. Bioresource Technology,98: 416.
