ÁREA: Ambiental
TÍTULO: Transesterificação etílica de óleo de soja via catálises básica e ácida
AUTORES: ARAUJO, L. R. R. (UERJ) ; ZOTIN, F. M. Z. (UERJ) ; SCOFIELD, C. F. (UERJ) ; RODRIGUES, T. V. (UERJ) ; LAVATORI, M. P. A. (UERJ) ; PORTILHO, M. (PETROBRAS)
RESUMO: A produção de biodiesel tem aumentado significativamente em muitos países, podendo-se utilizá-lo puro ou em misturas com o diesel proveniente do petróleo. O catalisador básico é o mais utilizado, pois o processo é mais rápido e as condições reacionais são mais brandas. Porém, na transesterificação catalisada por álcalis pode ocorrer, paralelamente, a reação de saponificação, que reduz a eficiência catalítica. Nestes casos, a opção seria utilizar a catálise ácida que, no entanto, exige um maior tempo de reação e uma razão molar álcool/óleo mais elevada. Assim, o objetivo deste trabalho é comparar o desempenho de diferentes sistemas catalíticos (ácidos e básicos) no processo de transesterificação do óleo de soja.
PALAVRAS CHAVES: biodiesel, transesterificação básica, transesterificação ácida
INTRODUÇÃO: O biodiesel é um combustível alternativo obtido, principalmente, através da transesterificação de óleos vegetais ou de outros materiais que contenham trialcilgliceróis como gorduras animais ou óleos usados de fritura, gerando os correspondentes ésteres monoalquílicos.
A produção de biocombustível como substituto ao óleo diesel fóssil tem sido alvo de diversos estudos nas últimas décadas (MEHER et al, 2006; VICENTE et al., 2004; SCHUCHARDT et al, 1998; MARCHETTI et al, 2007). A transesterificação de óleos vegetais é normalmente realizada com um álcool de cadeia curta (como metanol e etanol) e catalisadores ácidos ou básicos. A catálise ácida freqüentemente usa o ácido sulfúrico e o ácido clorídrico como catalisadores, enquanto que os catalisadores básicos mais usados são os hidróxidos de potássio e de sódio. Tanto a rota ácida quanto a rota básica apresentam vantagens e desvantagens. Na transesterificação catalisada por base, pode ocorrer, paralelamente, a reação de saponificação, que além de consumir o catalisador e reduzir a eficiência catalítica, aumenta a viscosidade do biodiesel e dificulta a etapa de purificação do mesmo. Já a catálise ácida exige um maior tempo de reação e uma razão molar álcool/óleo mais elevada. Conseqüentemente, a utilização de novos materiais catalíticos é desejável para o processo de transesterificação de oleaginosas.
Neste trabalho, comparou-se o desempenho de catalisadores básicos (hidróxido de potássio, etanolato de potássio, piridina e quinolina) e ácidos (ácido sulfúrico e pentóxido de nióbio) na reação de transesterificação etílica do óleo de soja comercial.
MATERIAL E MÉTODOS: No estudo da catálise básica e ácida na obtenção de ésteres visando a produção de biodiesel foi utilizado óleo de soja comercial e álcool etílico P.A. Foram testados catalisadores homogêneos e heterogêneos, a saber, dentre os básicos, hidróxido de potássio, etanolato de potássio e as bases orgânicas, piridina e quinolina, e dentre os ácidos, ácido sulfúrico e pentóxido de nióbio.
Devido às particularidades e limitações de cada catalisador, foram utilizados alguns parâmetros operacionais distintos na realização dos experimentos, mas que serão analisados na discussão dos resultados. Na catálise básica, trabalhou-se com 1% de catalisador e temperatura de 70ºC e tempo reacional de 2 h. Na catálise ácida homogênea (H2SO4) usou-se 2 % de catalisador e duas temperaturas, 70 e 130ºC, com os testes sendo realizados em 3 h. Finalmente, na catálise ácida heterogênea usou-se 2% de Nb2O5 e temperatura de 200ºC, mantendo o tempo de reação em 3 h.
A reação de transesterificação via catálise básica foi realizada em um balão de 500 mL sob agitação e aquecimento constantes. Seguindo a rota ácida, os experimentos foram feitos em reator de aço inox de 50 mL, com controle de temperatura e agitação e sob pressão autógena.
Após o tempo de reação estipulado, a reação era interrompida e a fase menos densa, contendo a mistura de ésteres etílicos, era separada por decantação e rotaevaporação. Após a purificação, essa fase era analisada por cromatografia em fase gasosa num cromatógrafo VARIAN, Modelo 3800, equipado com coluna capilar com fase estacionária de polietilenoglicol de 30 m e detector de ionização de chama.
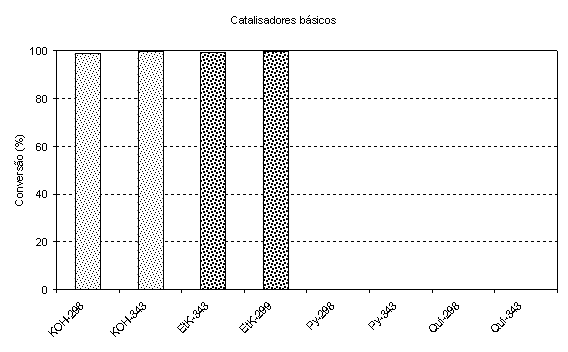
RESULTADOS E DISCUSSÃO: Os resultados da transesterificação básica encontram-se na Figura 1. O teor em ésteres do biodiesel gerado foi de aproximadamente 99% para os catalisadores hidróxido de potássio e etanolato de potássio, enquanto que as aminas aromáticas não foram eficientes nas condições empregadas. Este resultado pode ser explicado em função da basicidade da piridina e da quinolina, que indicam que são bases muito mais fracas que o hidróxido de potássio e o etanolato de potássio. A estrutura das moléculas aromáticas, em que o par de elétrons do nitrogênio está menos acessível ao reagente, também pode explicar a inatividade nas condições reacionais empregadas.
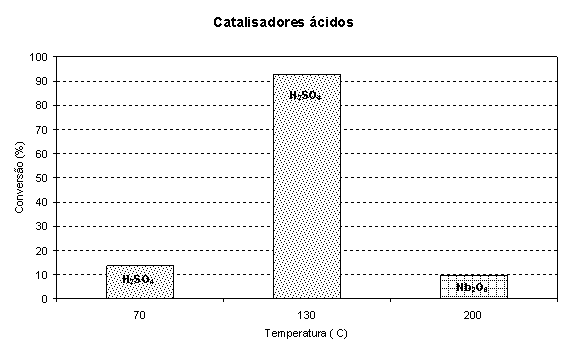
Os resultados da transesterificação ácida são apresentados na Figura 2. Observa-se que o ácido sulfúrico é muito mais efetivo na reação de transesterificação em relação ao catalisador de pentóxido de nióbio. Este último só mostrou atividade para temperaturas elevadas, e, a 200ºC, apresenta desempenho equivalente ao H2SO4 a 70ºC. O experimento realizado a 200ºC e sem catalisador não levou à obtenção de ésteres.
Comparando-se os resultados de catálise ácida e básica, observa-se que tanto o hidróxido de potássio como o etanolato de potássio são mais efetivos que o ácido sulfúrico que, para atingir conversões superiores a 90% necessitou de uma temperatura muito acima da utilizada nos experimentos com as referidas bases bem como de um tempo 50% maior. Por outro lado, as bases quinolina e piridina não apresentaram nenhuma atividade nas condições reacionais estudadas. O pentóxido de nióbio também se mostrou inativo em baixas temperaturas.
CONCLUSÕES: Os catalisadores KOH e etanolato de potássio foram os mais efetivos. As bases aromáticas não apresentaram atividade. O uso de catalisadores ácidos se justifica quando o teor de ácido graxo no óleo for elevado. Nesses casos, a utilização de H2SO4 seria uma boa alternativa, pois promove tanto a esterificação como a transesterificação, sem promover a saponificação. A catálise homogênea se mostrou mais promissora que a heterogênea. A dificuldade na separação desses catalisadores do produto encarece o processo e justificam novas pesquisas em busca de catalisadores heterogêneos efetivos.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: MEHER, L. C.; VIDYA SAGAR, D. e NAIK, S. N. 2006. Technical aspects of Biodiesel Production by Transesterication- a review. Renewable and Sustainable Energy Reviews, 10: 248-268.
VICENTE, G.; MARTÍNEZ, M. e ARACIL, J. 2004. Integrated Biodiesel Production: a comparison of different homogeneous catalysts systems. Bioresource Technology, 92: 297-305.
SCHUCHARDT, U.; SERCHELI, R.; VARGAS, R.M. 1998. Transesterification of vegetable oils: a review. Journal of Brazilian Chemical Society 9:199–210.
MARCHETTI, J.M.; MIGUEL, V.U.; ERRAZU, A.F. 2007. Possible methods for biodiesel production. Renewable and Sustainable Energy Reviews, 11: 1300-1311.
