ÁREA: Química Tecnológica
TÍTULO: RECICLAGEM QUÍMICA INCENTIVADA POR MICROONDAS DE PET PÓS-CONSUMO COMO FONTE DE INTERMEDIÁRIOS PARA RESINAS
AUTORES: JERMOLOVICIUS, L. A. (CEUN-IMT) ; AZEVEDO, M. (LAZZURIL) ; SENISE, J. T. (CEUN - IMT)
RESUMO: Desenvolveu-se uma alternativa de reciclagem de PET - poli(tereftalato de etileno) pós-consumo a qual efetivamente o elimine da biosfera e o transforme em produtos químicos intermediários para a indústria química. Para tanto, foi necessário superar a estabilidade química do PET de forma que esta molécula fosse controladamente seccionada. Uma reação química possível para esta quebra do polímero é a reação de hidrólise. A reação de hidrólise é lenta para ser empregada em processo industrial porém sob irradiação por microondas de 2,45 GHz torna-se rápida. Apresenta-se o processo estabelecido para esta hidrólise ácida incentivada por microondas e o perfil de massas moleculares obtidas em função da drasticidade desta hidrólise.
PALAVRAS CHAVES: reciclagem química, pet, microondas
INTRODUÇÃO: O poli(etileno tereftalato) é um poliéster que conquistou posição de destaque entre os termoplásticos devido as suas propriedades físicas e mecânicas ímpares, que lhe permitem deslocar outros materiais de construção [1], especialmente o vidro na área de embalagens. O constante surgimento de novas aplicações, à medida que as iniciais tornam-se maduras, permitem uma expectativa de crescimento de 4 % ao ano [1]. Sua produção mundial é estimada em 7 milhões de toneladas por ano [2], as quais terminam, inevitavelmente, como descarte sólido no lixo urbano. Isto traria um prognóstico terrível para o futuro da biosfera do planeta se a molécula do PET não permitisse sua reciclagem química.
A reciclagem química visa alterar a molécula de um resíduo, transformando-o em outras moléculas de interesse industrial. No caso do PET, estas reações de despolimerização são morosas e por esse motivo deixam de ser interessantes do ponto de vista industrial [3-8]. Neste contexto, surge uma alternativa para acelerar as reações, a Química Incentivada por Microondas [9-12]. Baseia-se em observações experimentais [13, 14] de que as reações realizadas sob campo de microondas são mais rápidas. Há duas referências para a hidrólise ácida de PET pós-consumo incentivada por microondas [15, 16], com a qual se consegue hidrolisar o PET a ácido tereftálico e etileno glicol em apenas 9 minutos [16].
No presente trabalho almeja-se comprovar a possibilidade de preparar hidrolisados de PET com diferentes massas moleculares e em tempos de processamento adequados para aplicação industrial. A finalidade destes hidrolisados é a de servirem de intermediários para resinas poliéster insaturadas e alquídicas.
MATERIAL E MÉTODOS: A hidrólise do PET pós-consumo foi realizada em um forno de microondas para digestão de amostras marca Milestone modelo MLS 1200, com seis vasos de digestão e implementos para medida de temperatura e pressão internas do vaso de referência. Um destes vasos tem entrada para dois sensores, um de temperatura e outro de pressão, que limitam e monitoraram a pressão e temperatura durante a digestão.
O PET pós-consumo utilizado, obtido de um reciclador, na forma de flocos (flakes) apresentava-se isento contaminantes como polietileno ou PVC. Estes flocos de PET tinham dimensão característica de até 8 mm.
Os vasos de digestão foram carregados com 0,6 g de flocos de PET e 25 mL de solução 3 M de ácido sulfúrico, e irradiados com 800 W de microondas de 2,45 GHz. Estas condições de trabalho foram otimizadas anteriormente [16].
O material foi irradiado por períodos de 3, 6 e 9 minutos, pois no trabalho anterior a despolimerização total era obtida em cerca de 9 minutos [16].
O produto de hidrólise foi filtrado e lavado com água até eliminação do ácido sulfúrico. A seguir, foi tratado com uma solução de hidróxido de sódio a 10 % para dissolver os cristais de ácido tereftálico formado. Isto foi imprescindível no teste de 6 e 9 minutos. O polímero restante desta extração alcalina foi lavado com água até eliminação da soda. Os filtrados e as águas de lavagem foram descartados. A torta final de filtração foi seca em estufa.
Determinou-se a massa molecular viscosimétrica média dos resíduos de hidratação pelo método da viscosidade intrínseca [17-20].
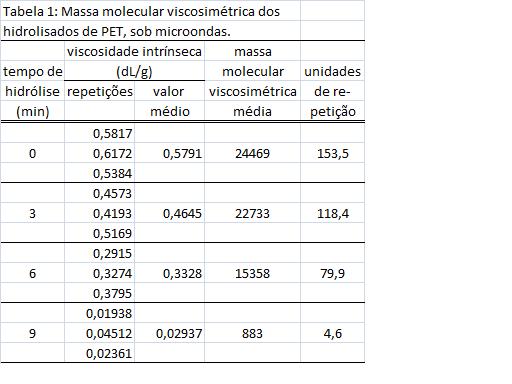
RESULTADOS E DISCUSSÃO: A tabela 1 apresenta os resultados obtidos para três testes de despolimerização de PET pós-consumo em flocos, com três repetições. No tempo “zero” é apresentado o peso molecular do PET reciclado empregado nestes testes.
Observa-se uma diminuição do peso molecular à medida que o tempo de irradiação aumenta, como era esperado, mostrando que a despolimerização ocorre por etapas sucessivas. A macromolécula sofreu a ação hidrolítica da água catalisada por ácido sulfúrico gerando moléculas com mesma estrutura do PET, porém com comprimento de cadeia diminuído. Após tempo maior de exposição, estas moléculas intermediárias têm o seu peso molecular reduzido continuamente até que se transformem em ácido tereftálico e etileno glicol. Nos testes finais a presença do ácido tereftálico foi bem notada com a presença de seus cristais. O etileno glicol ficou miscível na solução hidrolítica.
Nos testes até 6 minutos, o resíduo sólido da hidrólise apresentava aspecto diferente do PET inicial, estava opaco e dava a impressão que sofrera fusão. Já aos nove minutos, observaram-se partículas cristalinas de ácido tereftálico.
Admite-se que o material polimérico de peso molecular reduzido que foi obtido tenha como grupos terminais uma carboxila e uma hidroxila glicólica.
É preciso ressaltar que no estado da arte, a cisão da molécula do PET é lenta, podendo levar de várias horas até dias para se completar, enquanto que no processo incentivado por microondas a duração da hidrólise é bem inferior a uma hora.
CONCLUSÕES: Com o uso de microondas de 2,45 GHz é possível preparar intermediários bifuncionais, de função mista carboxilácido/glicol, para a preparação de novas resinas, tanto resinas poliéster insaturadas como alquidicas, onde parte das matérias primas convencionais é substituída pelo polímero de peso molecular reduzido resultado desta hidrólise ácida.
Uma grande vantagem que se abre para os formuladores de resinas é a possibilidade de contarem com intermediários bifuncionais de peso molecular no valor que desejarem. Bastando para tal, hidrolisarem por um tempo adequado o PET pós-consumo.
A vantagem maior que se obtém, entretanto, é a alta velocidade de reação que as microondas permitem atingir, tornando comercialmente viável a reciclagem química do PET pós-consumo.
AGRADECIMENTOS: Os autores agradecem a colaboração de P. Azzi, R. B. do Nascimento, E, R. de Castro e L. F. B sa Silva e o suporte do Instituto Mauá de Tecnologia.
REFERÊNCIAS BIBLIOGRÁFICA: [1] CHEMPROFILES, http://www.the-innovation-group.com/ChemProfiles/Polyetylene%20 Terephthalate, acessado em 6/6/2008.
[2] GRUPO MOSSI & GRISOLFI, Reciclagem e responsabilidade Social. http://www. gruppomg.com.br/empresa/
reciclagem.htm, acessado em 6/6/2008.
[3]DONAHUE, C. J., EXLINE, J. A., WARNER, C., Chemical recycling of pop bottles: the synthesis of dibenzyl terephthalate from the plastic polyethylene terephthalate. J. Chem. Ed., 80(1)79-82, Jan. 2003.
[4]SHUKLA, S. R. and HARAD, A. M., Aminolysis of polyethylene terephthalate waste. Polymer Degradation and Stability, 91(2006)1850-1854.
[5] TONG, S. N., CHEN, C. C., CHUNH, L. Z., Unsaturated polyesters based on bis(2-hydroxyethyl)terephthalate. Polymer, 24, 469-472, Apr. 1983.
[6] MANSOUR, S. H. and IKLADIOUS, N. E., Depolymerization of poly(ethylene terephthalate) wastes using 1,4-butanodiol and triethylene glycol. Polymer Testing, 21(2002)497-505.
[7] YOSHIOKA, T., MOTOKI, T. OKUWAKI, A., Kinetics of hydrolysis of poly(ethylene terephthalate) powder in sulfuric acid by modified shrinling-core mode. Ind. Eng. Chem. Res., 40(2001)75-79.
[8] YOSHIOKA, T., OKAYAMA, N., OKUWAKI, A., Kinetics of hydrolysis of PET powder in nitric acid by a modified shrinking model. Ind. Eng. Chem. Res., 37(1998)336-340.
[9] STRAUSS, C. R. and TRAINOR, R. W., Developments in microwave-assisted organic chemistry. Aust.J. Chem., 48(1995)1665.
[10] LINDSTRÖM, p., TIERNAEY, J., WATHEY, B., WESTMAN, J., Microwave assisted organic synthesis – a review. Tetrahedron, 57(2001)9225-9285.
[11] KINGSTON, H. M. ed and HASWELL, S.ed, Microwave-enhanced chemistry. Fundamentals, sample preparation and applications. USA, ACS, 1997.
[12] SENISE, J. T. and JERMOLOVICIUS, L.A., Microwave chemistry – a fertile field for scientific research and industrial applications. J. Microwave and Optoelectronics, 3(5)97-112, Jul.2004.
[13] GEDYE, R. N., SMITH, F., WESTAWAY, K., ALI, H., BALDISERA, L., TOUSSEL, J., The use of microwave ovens for rapid organic synthesis. Tet. Lett. 27(1986)279-282.
[14] GUIGUERE, R., BRAY, T. L., DUNCAN, S. M., MAJETICH, G., Application of commercial microwave ovens to organic synthesis. Tet. Lett., 72(1986)4945-4948.
[15] JERMOLOVICIUS, L. A., SENISE, J. T., BUSSO, R. del, CARDOSO FILHO, E. P., Recuperação de ácido tereftálico a partir de resíduos de PET via hidrólise estimulada por irradiação com microondas. IX SILUBESA – Simp. Luso-Bras. Eng. Sanit. Amb., Porto Seguro, 9-14 de abril, 2000, 2907-2811.
[16] JERMOLOVICIUS, L. A. e MURANAKA, C. T., Processo de hidrólise ácida de polímeros. Patente BR0600637, PAPESP, 2007.
[17] MC CAFFERY, E. L., Laboratory preparation for macromolecular chemistry. USA, McGraw Hill, 1970, cp 2.
[18] BRANDRUP, J. ed.; IMMERGUT, E. H.. Polymer handbook. New York: John Wiley , 1989.
[19] RANGEL, R. N., Práticas de físico-química. 3ed, Brasil, Blücher, 2006, cp. 7.
[20] LUCAS, E. F., SOARES,B. G., MONTEIRO, E. C., Caracterização de polímeros. Brasil, e-Papers, 2001, cp. 6.
