ÁREA: Materiais
TÍTULO: SINTESE E CARACTERIZAÇÃO DA HIDROTALCITA Mg/Al,Ce-CO3 E SEUS ÓXIDOS DERIVADOS.
AUTORES: PEREIRA, P.M (UFPA) ; RODRIGUES, E. (UFPA) ; SILVA, H.M.N. (UFPA) ; MARTINS,T. (UFPA) ; BATISTA,J. (UFPA)
RESUMO: O composto tipo hidrotalcita [M2+(1-x)M3+x(OH)2]x+(A x/n)n-.yH20], x = 0,25, contendo Mg2+,Al3+ e Ce3+ , foi sintetizado pelo método de co-precipitação, descrito por Reichle (1985), utilizando banho ultrasônico por 24h/48°C como método de homogeneização. O material sintetizado foi submetido ao tratamento térmico (500°C e 650ºC). O material apresentou difratogramas característicos de hidrotalcita, aumento na cristalinidade com a elevação da temperatura e produção de óxidos simples (CeO2 e MgO) após o tratamento térmico. Não foi observado efeito de memória, assim como a presença de óxidos duplos. Todos os materiais foram caracterizados por: Difração de Raios-X, Microssonda eletrônica de Varredura
PALAVRAS CHAVES: hidrotalcita, cério, óxidos.
INTRODUÇÃO: Hidrotalcitas são argilas aniônicas naturais ou sintéticas que apresentam estrutura semelhante à da Brucita, onde os cátions divalentes M2+ (Mg,Zn,Co,..,) encontram-se substituídos isomorficamente por cátions trivalentes M3+ (Al, Fe, Cr,...,). O excesso de carga positiva, gerado por esta substituição, é compensado por ânions An- (SO4, NO3, Cl, ...), em geral utiliza-se o CO3 devido à estabilidade que ele confere as lamelas. A cristalinidade e estabilidade deste material esta associada a fatores como: relação M2+/M3+ de 1 a 8, raio iônico (0,5 a 0,74 Å) e razão molar x ( 0,17 a 0,33)(RIVES., 2001).
Estes materiais podem ser sintetizados e constituem uma classe de materiais com potencial aplicação na área de catálise (CANTRELL et al., 2005). As hidrotalcitas quando submetidos ao tratamento térmico, usualmente produzem óxidos simples e duplos, os quais apresentam elevada área superficial, fortes sítios básicos de Lewis e alta estabilidade térmica. Um comportamento freqüentemente observado neste material refere-se ao efeito de memória, que consiste na reconstrução da estrutura original do composto quando em contato com o ar atmosférico (KLOPROGGE et al.,2002)
O presente trabalho apresenta os resultados obtidos por diversas técnicas complementares: Difração de Raios-X (DRX), Microssonda Eletrônica (ME) e Microscopia Eletrônica de Varredura (MEV) para a hidrotalcita sintética Mg/Al,Ce-CO3 e seus derivados e avalia a inserção do cério, ri = 1,02Å, na estrutura do material, assim como a sua viabilidade como precursor de óxidos simples para potencial uso em catálise heterogênea
MATERIAL E MÉTODOS: A hidrotalcita Mg/Al,Ce-CO3, foi sintetizada de acordo com os procedimentos de co-precipitação, descritos por (REICHLE.,1985), com modificação no processo de homogeneização e controle de pH. Foram utilizadas soluções aquosas de nitratos dos precursores e soluções básicas de carbonato e hidróxido de sódio como agentes precipitantes. O material obtido permaneceu sob agitação à 321K por 24h em banho ultrasônico. A suspensão obtida passou por um processo de lavagem e envelhecimento à 24h, com controle de pH(10). O material foi seco à 373K/24h. O tratamento térmico foi efetuado em diferentes temperaturas (773K e 923K). No decorrer do trabalho as amostras serão denominadas: Ce-HDL (sem tratamento térmico), Ce-HDL500 (tratamento térmico á 773K) e Ce-HDL 650 (tratamento térmico á 923K).
As condições experimentais utilizadas foram: DRX (Philips, X’PERT PRO PW3050), Cuλα = 1,54056 Å, 2θ= 5° a 70°, 2°/min, 40kV, 40mA e tempo de 20s, MEV (Zeiss-LEO 1430),25kV, 40mA, metalização (carbono) e ME (Cameca SX-100), 15 kV, 20mA, feixe 1 µm, os padrões utilizados foram Periclásio e Corindon (SXGeo) para Al e Mg e Monazita (Astimex MINM25-5332) para o Ce.
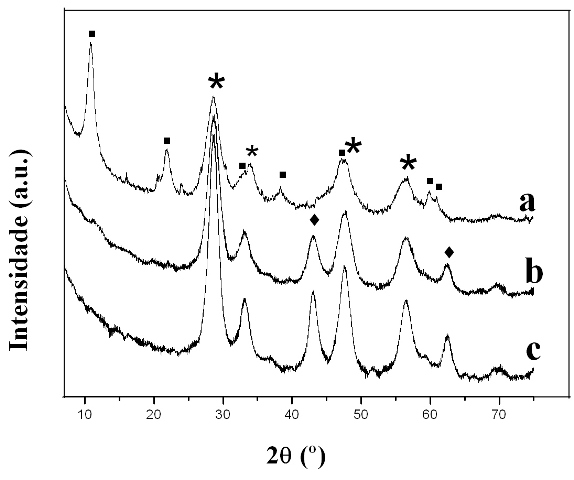
RESULTADOS E DISCUSSÃO: O difratograma da amostra Ce-HDL (Fig.1) é bastante similar ao apresentado na literatura para a hidrotalcita estequiométrica (JCPDS 14.0191), entretanto com grau de cristalização inferior, reportado pela intensidade e definição dos picos. Os picos principais da hidrotalcita [(003), (006), (012), (015), (018), (110), (113)] foram indexados. Além disso, foi observado um ligeiro aumento nos parâmetros da cela unitária [a=b (3,09 Å), c (24,31 Å) e V (200,09 Å)] quando comparados à hidrotalcita estequiométrica, (DAS et al., 2006). Esses resultados são coerentes com a possível incorporação do Cério na estrutura do mineral. Fases anexas [CeO2; Ce2O(CO3)2H2O] também foram registradas (Fig.1). Nas amostras calcinadas(Fig.1) o estreitamento dos picos observados, assim como a melhor cristalização do material são decorrentes do tratamento térmico ao qual foi submetido às amostras. A presença de duas fases (CeO e MgO) também foram observadas. Entretanto não foi observado o efeito de memória, nem a presença de óxidos duplos.
Figure 1: DRX das amostras: a) Ce-HDL b) Ce-LDH 500 c) Ce-LDH 650.
As micrografias da amostra Ce-HDL, evidenciam as dimensões reduzidas da amostra sintetizada, assim como a presença de aglomerados em torno de 100 µm. Há formação de cristais com tamanho de cristalito em torno de 2µm. A fase cúbica acessória (CeO2) (Fig.2) está em concordância com o difratograma registrado para a amostra.
Figura 2. Micrografia da amostra Ce-HDL, fase cúbica acessória CeO2.
A incorporação do cério na estrutura da hidrotalcita ficou evidente pela análise realizada por ME que quantificou teores de cério (1,19) ligeiramente inferiores aos de Alumínio (1,52), a razão M2+ /M3+ (2.7) também apresentou um valor inferior á aquele reportado na literatura para a hidrotalcita sintética.
CONCLUSÕES: A cristalização de uma hidrotalcita com teor de Cério equivalente ao de Alumínio foi evidenciada pelas técnicas analíticas (DRX,MEV,ME), comprovando que é possível introduzir elementos com raio iônico superiores aos descritos na literatura sem provocar o colapso da estrutura da hidrotalcita. O efeito de memória não foi observado por DRX, assim como a existência de óxidos duplos. Porém, são formados óxidos simples que futuramente poderão serem aplicados em processos catalíticos.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: BIRJEGA, R.; PAVEL, O.D.; CONSTENTIN, G.; ANGELESCU, E. (2005) Apply. Cat A. 185-193.
CANTRELL, D. G., GILLIE, L. J., LEE, A. F.; WILSON, K. (2005). Appl. Catal. 287, 183-190.
DAS, J., DAS,D., PARIDA,K.M., (2006). Journal of Colloid and Interface Science. 301, 569-574.
KLOPROGGE, T.; WHARTON, D.; HICKEY, L.; FROST, R. L. (2002) Amer. Mineral. 87, 623-629
REICHLE, W.T. (1985). J. Catal. 94, 547-557.
RIVES. V. Layered Double Hydroxides: Present and Future, Nova Science Publishers, Inc. New York, 439p.2001.
