ÁREA: Físico-Química
TÍTULO: Determinação de amônia gerada em atmosfera padrão utilizando eletrodos modificados de polipirrol e DBSA
AUTORES: GIAROLA, D. A. (UEL) ; MARTINS, V. L. (UEL) ; SOLCI, M. C. (UEL) ; DALL’ANTONIA, L. H. (UEL)
RESUMO: O trabalho teve como objetivo a determinação e quantificação de NH3 através de filmes de polipirrol (PPy) dopado com DBSA depositado sobre superfícies de platina, a fim de estudar suas propriedades em relação à detecção de amônia. O filme polimérico foi formado sobre o eletrodo, a + 0,70 V vs. Ag/AgCl, a partir de uma solução contendo o monômero pirrol e o sal anfifílico. Voltametrias cíclicas, entre - 1,0 até + 0,5 V vs. Ag/AgCl, foram repetidas acrescentando diferentes concentrações de NH4Cl A amônia quantificada foi gerada em atmosfera padrão através de tudo de permeação e coletada em frasco borbulhard contendo solução adsorvente. A taxa de permeação foi de 1,27 ± 0,01 10-4 mol.min-1 quantidade compatível com a taxa de referencia de 1,30 ± 0,12.10-4 mol.min-1.
PALAVRAS CHAVES: amônia, polipirrol, dbsa
INTRODUÇÃO: A síntese de eletrodos quimicamente modificados (EQM) propicia à manipulação de sua seletividade, sensibilidade, simplicidade de construção, e monitoramento do analíto de interesse[1]. Um dos principais objetivos da modificação de eletrodos é melhorar a capacidade de reconhecimento e amplificar sinais de corrente ao passo que a seletividade aumenta pelo efeito eletrocatalítico induzido pelo modificador[2]. Uma alternativa para a modificação é o uso de polímeros condutores na síntese do eletrodo. Os polímeros condutores apresentam ligações pi (π); conjugadas que possibilitam uma transferência eletrônica interna, acarretando em uma elevada condutividade elétrica. Mas suas propriedades não se restringem apenas a condutividade elétrica, eles são leves, de fácil síntese e apresentam baixo custo[3]. Vários são os polímeros condutores estudados entre eles se destaca o Polipirrol[4]. Recentes estudos demonstraram que filmes de polipirrol dopados com dodecilbenzenosulfonato (DBSA) mostraram-se muito promissores para serem empregados na construção de sensores amperométricos para determinação de quantidades de amônia, uma vez que a sensibilidade à amônia estende-se por uma região (0 a 1 mM) até quatro vezes maior do que filmes dopados com íons cloreto e apresentam uma resposta de corrente bastante acentuada[5,6,7]. Neste trabalho a NH3 detectada e quantificada é obtida pelo método de geração de atmosfera padrão gasosa utilizando tudo de permeação. O processo de permeação envolve a vaporização de um composto líquido, dissolução do composto gasoso no material permeável, difusão através do material permeável, difusão através do material permeável e liberação para a superfície externa[8].
MATERIAL E MÉTODOS: Os filmes de PPy são preparados a partir de solução dopada com DBSA, aplicando-se um potencial de 0,75 V com potenciostato por 360 segundos, a fim de se obter a espessura do filme sobre o eletrodo de platina.
Após lavar com água destilada o eletrodo de platina com o filme depositado, realiza-se a voltametria cíclica em KCl 0,1 mol L-1 com H3PO4 0,01 mol L-1 a uma velocidade de 20 mV/s em um intervalo de potencial de -1,0 a 0,5 V.
Para construção da curva de calibração foram realizadas diversas voltametrias cíclicas, variando-se a concentração de NH4Cl (1.10-4 a 9.10-4 mol L-1). Para isto utilizou-se de 10 mL KCl 0,1 mol L-1 com H3PO4 0,01 mol L-1, ao qual foi adicionado volumes de solução de NH4Cl 1,0 mol L-1 com KCl 0,1 mol L-1 e H3PO4 0,01 mol L-1, para cada concentração estabelecida.
A curva de calibração obtida para concentrações segue a equação: i = 0,028C – 1,276.10-4 (r2 = 0,997); onde i = corrente, C = concentração, 10-4 mol L-1 e r = coeficiente de correlação linear. Para cada concentração anota-se o valor da corrente de pico que é utilizada como curva de calibração.
Para avaliação do método proposto foi utilizado ar contendo quantidade conhecida de NH3. Para geração do padrão gasoso de NH3 o ar ambiente foi previamente purificado para ser utilizado como diluente do NH3 emitido pelo tubo de permeação e gerar o padrão gasoso. A purificação do ar foi obtida, fazendo-o atravessar por colunas de sílica gel e ácido cítrico, respectivamente. Na seqüência, o ar purificado passa por um rotâmetro para controle da vazão de ar e depois pela câmara de vidro contendo um tubo de permeação de NH3. No final a amônia é coletada através de borbulhamento em 5 mL de solução adsorvente (H3PO4 0,01 mol L-1).
RESULTADOS E DISCUSSÃO: A taxa de permeação obtida pelo método gravimétrico foi de 1,30 10-4 mol.min-1 a 35 °C, esta taxa será a referência para a determinação eletroquímica da amônia.
As quantidades de amônia determinada pelo método eletroquímico, em 1 minuto de amostragem, coletada em 5 mL de solução H3PO4 0,01 mol L-1 são apresentados na Tabela 1. A média da taxa de permeação foi de 1,28.10-4 mol min-1, com desvio padrão de 9,45%. Os resultados apresentados na Tabela 01 encontram-se dentro do limite de confiabilidade (95%), ou seja, 1,12.10-4 mol < µ < 1,43.10-4 mol de amônia.
O eletrodo modificado de PPy dopado com DBSA também foi utilizado para avaliar a estabilidade do sistema de geração de NH3 após 9 horas consecutivas de permeação. Coletou-se NH3 em frasco borbulhador em intervalos de tempo de 1, 3, 6 e 9 horas. Os resultados da determinação da taxa de permeação pelo método eletroquímico são apresentados na Tabela 2. As médias da taxa de permeação determinadas pelo método eletroquímico, para a variação de tempo proposta, foi de 1,27.10-4 mol min-1 com os desvios padrão de 1%, respectivamente.

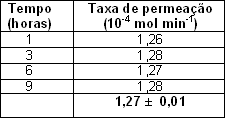
CONCLUSÕES: Os resultados mostrados aqui dão uma idéia do potencial do polímero polipirrol dopado com DBSA como sensor de NH3. Os resultados obtidos pelo método eletroquímico são condizentes com a taxa de referência de permeação de NH3 em atmosfera padrão. O valor obtido para taxa de permeação determinada pelo método eletroquímico foi de 1,27 ± 0,01 10-4 mol min-1, equivalente a taxa de permeação de referência.
AGRADECIMENTOS: Laboratórios LACA e LEMA. CNPq e CAPES.
REFERÊNCIAS BIBLIOGRÁFICA: 1. Kubota, L.T.; Pereira A.C; Santos A.S.; Química Nova 2002, 25, 1012.
2. Lowinsohn, D.; Bertotti, M. , Química Nova 2006, 29, 1320.
3. Mattoso, L.H.C.; Química Nova 1996, 19; 388.
4. Kanazawa, K. K.; Diaz, A. F.; Geiss, R. H.; Gill, W. D.; Kwak, J. F.; Logan, J. A.; Rabolt, J. F.; Street, G. B. Journal of the Chemical Society- Chemical Communications, 1979, (19) 854-855.
5. Dall’Antonia, L. H.; Miyata, M. E. V.; Cordoba De Torresi, S. I.; Torresi, R. M. Electroanalysis, New York, 2002, 14 (22), 1577-1586.
6. Vidotti, M.; Dall’antonia, L. H.; Bergamaski, K.; Nart, F. C.; Cordoba De Torresi, S. I. Analytica Chimica Acta, Amsterdam, 2003, 489 (2), 207-214.
7. Vidotti, M.; Dall’antonia, L. H.; Cintra, E. P.; Cordoba De Torresi, S. I. Electrochimica Acta, New York, 2004, 49 (22/23), 3665-3670.
8. Choi, M. F.; Hawkins, P. Analytical Chemistry, 1997, (69), 1237-1239.
