ÁREA: Físico-Química
TÍTULO: FORMAÇÃO E CARACTERIZAÇÃO DE ELETRODEPÓSITOS DE Zn PROVENIENTES DE PILHAS DE Zn-MnO2 EXAURIDAS
AUTORES: SOUSA, M.S. (UFES) ; GARCIA, E.M. (UFES) ; CELANTE, V. G. (UFES) ; FREITAS, M. B. J. G. (UFES)
RESUMO: Neste trabalho foi estudado o processo de reciclagem eletroquímica de pilhas exauridas de Zn-MnO2 pela eletrodeposição de Zn, Mn e ligas Zn-Mn por meio de técnicas potenciodinâmicas e galvanostáticas em diferentes substratos e condições de pH a fim de otimizar as condições de síntese do processo e esses depósitos foram caracterizados por MEV com EDX. Análise por EIE mostra que o circuito equivalente apresenta uma componente RQ e uma componente difusional de Warburg. Na caracterização morfológica dos eletrodepósitos de zinco, observou-se que, mantendo-se a densidade de corrente constante, em pH 0,5, o depósito é dendrítico e em pH 2,0 o depósito é homogêneo com formação de grãos bem definidos. A reciclagem deve diminuir a quantidade de pilhas nos lixões, preservando o meio ambiente.
PALAVRAS CHAVES: eletrodeposição, baterias zn-mno2, reciclagem
INTRODUÇÃO: As baterias primárias alcalinas, também conhecidas como pilhas, são constituídas por um ânodo (Zn), um cátodo (formado por MnO2 e carbono), eletrólito (NaOH/KOH ou ZnCl2/NH4Cl), separadores de papel e o invólucro externo. Após serem exauridas, estas pilhas são descartadas no lixo comum, de acordo com a resolução CONAMA 401/081, seguindo posteriormente para aterros sanitários e incineradores. Com isso, para diminuir este impacto ambiental, é necessário o desenvolvimento de processos e técnicas para o reaproveitamento destes materiais. Uma destas técnicas é por meio de reciclagem dos metais presentes nestas pilhas por meio de técnicas eletroquímicas. A reciclagem apresenta-se, então, como uma solução para esta questão ambiental. No início, a reciclagem e a recuperação de materiais foi a possibilidade para que cada indústria mantivesse o fornecimento de matéria-prima a um custo razoável, inclusive nos períodos de escassez. Hoje em dia, a principal razão para a reciclagem, ou o tratamento final, é a proteção do meio ambiente. O objetivo desse trabalho é a aplicação de métodos eletroquímicos para a reciclagem de zinco e manganês de pilhas de Zn-MnO2. As condições eletroquímicas na formação de eletrodepósitos de zinco, manganês e ligas Zn-Mn serão estudadas em condições galvanostáticas e potenciodinâmicas e eletrodepositados sobre os eletrodos de Pt, aço carbono 1020 e carbono vítreo a fim de se otimizar as condições de síntese do processo, verificando ainda a influência na morfologia dos eletrodepósitos por microscopia eletrônica de varredura (MEV).
MATERIAL E MÉTODOS: As baterias de Zn-MnO2 foram fisicamente desmanteladas e seus materiais foram dissolvidos em H2SO4 3,0 mol L-1 + 30% H2O2 v/v para otimizar a dissolução2.
Montou-se um sistema de agitação magnética e a reação se processou durante três dias. Também foi usada a relação de 1,0000 g do cátodo e do ânodo, 100,0 mL de ácido e mais 1,0 mL de H2O2 30%. Por análise de ICP-OES, a composição das diferentes soluções foi analisada. Na Solução A, correspondente a dissolução do ânodo, a concentração de íons Zn2+ é 1,12 mol L-1 e a concentração de íons Mn2+ é menor que o Limite de Detecção. A dissolução do cátodo, chamada de solução B, a concentração dos íons Mn2+ na solução é de 1,03 mol L-1 e de Zn2+ é 0,001 mol L-1. Na solução C, referente a dissolução do ânodo e cátodo juntos, a concentração de íons Mn2+ na solução é de 1,01 mol L-1 e de Zn2+ é 0,29 mol L-1.
Para a realização das medidas eletroquímicas foram utilizadas células de com capacidade aproximada de 60,00 mL. Essas células continham três orifícios na tampa da célula para a introdução do eletrodo de referência, auxiliar e de trabalho. Os eletrodos utilizados foram o eletrodo de trabalho de aço 1020, carbono vítreo e platina, o eletrodo de referência (Ag/AgCl/NaCl saturado) e o contra-eletrodo de platina. Foi utilizado o Potenciostado/Galvanostato AUTOLAB PGSTAT 100. Os materiais foram caracterizados com o auxílio das técnicas de MEV e EDX.
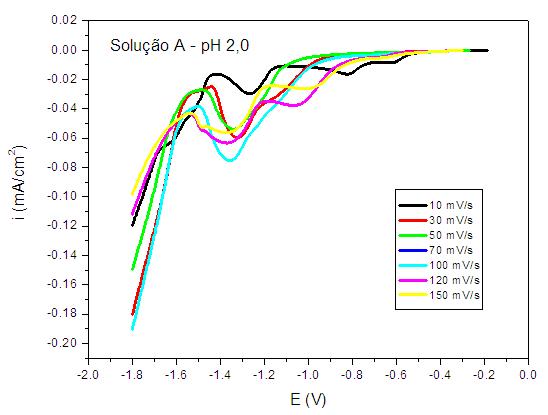
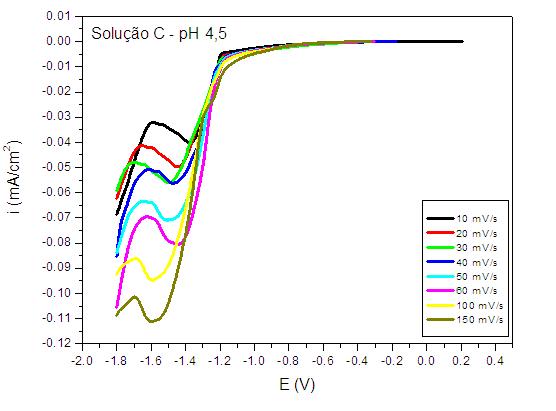
RESULTADOS E DISCUSSÃO: A Figura 1 a seguir, mostra que nas medidas potenciodinâmicas realizadas com a solução A, a adição de citrato tende a levar o potencial de redução do Zn para regiões mais catódicas (-1,4 V). Antes deste potencial, ocorre o aparecimento de um pico, podendo estar relacionado com um processo de deposição em duas etapas. Apenas em valores de pH maiores que 0,46 ocorre eletrodeposição potenciodinâmica. Na Figura 2, a eletrodeposição de ligas Zn-Mn a partir da solução C mostra que na região de -1,6 V ocorre um pico de deposição, podendo estar relacionado à deposição simultânea de Zn e um óxido de manganês.
Por meio da técnica galvanostática obteve-se preferencialmente depósitos de Zn, independente da densidade de corrente e pH trabalhados3. A análise por MEV o depósito formado em pH 0,46 apresenta a forma dendrítica, enquanto que com o aumento da densidade de corrente aplicada e do pH para 2,0, o depósito torna-se mais homogêneo. Com o aumento da densidade de corrente aplicada, observou-se que ocorre um aumento da resistência de polarização e conseqüentemente uma diminuição da taxa de corrosão, medidos pelas curvas de Tafel obtidas.
Análise por espectroscopia de impedância eletroquímica (EIE) mostra que o circuito equivalente apresenta uma componente RQ, relacionada com uma camada não homogênea de eletrodepósito e uma componente difusional de Warburg, referente a difusão dos íons do eletrólito para o depósito.
CONCLUSÕES: A eficiência da eletrodeposição de Zn para o experimento galvanostático é da ordem de 77%. Os eletrodepósitos de Zn formados sobre substrato de aço carbono 1020 mostram a proteção do eletrodo de trabalho frente ao aumento da densidade de corrente de deposição. A EIE indica um elemento de fase constante, relacionado com a irregularidade do eletrodepósito. A deposição de Mn não foi observada nos eletrodepósitos realizados.
AGRADECIMENTOS: Ao meu orientador Prof. Dr. Marcos Benedito José Geraldo de Freitas e aos amigos Vinicius e Eric pela ajuda e paciência.
REFERÊNCIAS BIBLIOGRÁFICA: [1] ABINEE (Associação Brasileira da Indústria Eletro-Eletrônica), abinee.org.br
[2] CONSELHO NACIONAL DO MEIO AMBIENTE (CONAMA), Resolução n. 257, 30 de Junho 1999, Publicado no Diário Oficial da União (DOU) 22 de Julho 1999.
[3] Freitas, M.B.J.G., Pietre, M.K. de, J. Pwr. Sourc., 128 (2004), 343.
