ÁREA: Química Analítica
TÍTULO: PHMETRO MICROCONTROLADO E INTERFACEADO DE BAIXO CUSTO
AUTORES: SILVA, P. R. D. (FACIT) ; MATRANGOLO, P. F. R. (FACIT)
RESUMO: O presente trabalho descreve a construção e avaliação de um phmetro micro-controlado que pode ser utilizado em diversos processos tecnológicos, como por exemplo estações de tratamento de água e fermentadores biológicos. O sistema utiliza um controlador que tem internamente partes que minimizam o seu tamanho e reduzem custos, mantendo a confiabilidade e possibilitando a implementação de diversos controles.
PALAVRAS CHAVES: phmetro, interfaceamento, controladores
INTRODUÇÃO: Mesmo com a utilização de equipamentos de análise cada vez mais sofisticados, o pHmetro até hoje continua sendo utilizado em todos os laboratórios. Com isso, desenvolveu-se um equipamento de baixo custo, utilizando um micro-controlador PIC16F877 e alguns componentes discretos, facilitando o interfaceamento com um micro computador que, com um programa específico, consegue visualizar os dados coletados em forma de planilhas ou até construir gráficos. O controlador escolhido possui oito conversores analógicos digital, em um total de 33 portas que podem ser configuradas como saída ou entrada digitais. O circuito foi dividido em duas partes para facilitar o entendimento.
Uma sonda de pH tem na sua saída uma tensão inversamente proporcional ao pH da solução, tendo como zero o pH neutro, ou seja, pH = 7. Se o pH da solução for maior do que 7 a tensão será negativa e se o pH for menor do que 7 a tensão será positiva, sendo que as mudanças são de aproximadamente 60 mV por unidade de pH gerado na sonda. Por exemplo, para um pH = 5 a tensão de saída da sonda será aproximadamente 120mV e para um pH = 8,5 teremos uma tensão de -90mV. A equação abaixo fornece o valor da tensão gerada (Vin) pelo eletrodo na saída do circuito amplificador.
Vin = 0,060 (7 – pH)
Como a corrente fornecida pela sonda é muito baixa, foi utilizado um amplificador com uma alta impedância de entrada que multiplica o valor de entrada por aproximadamente 1,7.
Vin = 1,7 [ 0,060 (7 – pH)] ~ 0,1 (7 – pH)
Em seguida subtraímos desta tensão 0,7 V para que tenhamos um sinal de 100 mV por pH. Este sinal segue para um filtro passa baixa com uma freqüência de corte de aproximadamente de 10Hz, para evitar que ruídos e oscilações passem para a parte de leitura.
MATERIAL E MÉTODOS: As soluções foram preparadas utilizando água deionizada e reagentes de grau analítico. Utilizou-se soluções tampão de pH= 4 e pH = 7, marca CRQ, solução de NaOH (SYNTH), solução de HCl (QEMIS) e solução de KCl 3,0 mol. L-1 (ALFAKIT) para a sonda de pH. Utilizou-se um peagâmetro de referência marca ANALYSER modelo pH300 M com eletrodo de pH modelo 2A09E, marca ANALYSER, devidamente limpo e cheio com uma solução KCl 3,0 mol. L-1.
Realizou-se a calibração dos peagâmetros com soluções tampão de pH 4,0 e 7,0. Após a calibração realizou-se uma titulação de 20 mL de HCl 0,5 mol. L-1 pela adição de volumes discretos de NaOH 0,5 mol. L-1. Mediu-se o pH da solução inicial e, após cada adição de base, o valor de pH, após estabilizado, foi medido. Os valores coletados foram utilizados na construção da curva de titulação.
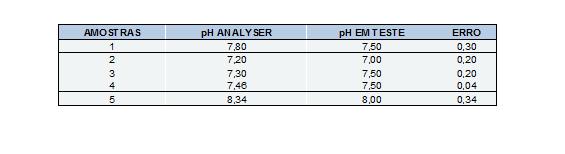
Realizou-se ainda a leitura de 5 amostras de água, oriundas de uma Estação de Tratamento de Efluentes, confrontando os resultados obtidos pelo peagâmetro desenvolvido com os obtidos pelo peagâmetro de referência.
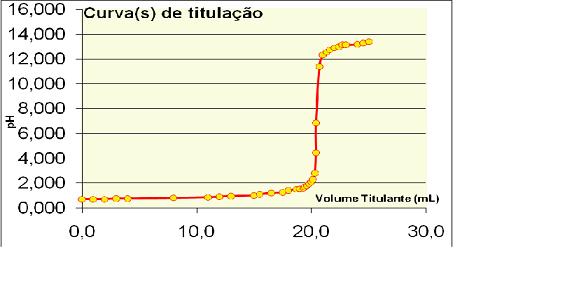
RESULTADOS E DISCUSSÃO: A aquisição dos valores de pH da solução de HCl 0,5 mol/ L após a adição dos volumes de NaOH 0,5 mol/L gerou o gráfico abaixo (Figura 01). Pelo gráfico, percebe-se que o volume e o pH no ponto de equivalência encontram-se próximos aos valores esperados. (volume de titulante de 20mL e pH 7). Quando o volume de titulante foi de 20,5 mL observou-se um valor de pH igual a 6,85.
A análise das amostras de água (Figura 02) mostra que os resultados obtidos pelo peagâmetro desenvolvido ficam próximos aos valores encontrados pelo peagâmetro de referência.
As condições sob as quais a calibração acontece constituem item relevante no processo de medição do pH de uma solução. Segundo Meinrath e Spitzer (2000), tratando-se da medição de pH, o experimento não é diferente de um outro experimento usando outro equipamento, como exemplo, medições em Espectrofotômetro de Absorção Atômica, visto que o dispositivo necessita ser calibrado com o uso de padrões, gerando dependência da exatidão dos padrões. Além disso, segundo Buck et al. (2002), como o potencial do eletrodo de vidro depende da temperatura, faz-se necessário que a calibração e a medição aconteçam sob condições controladas de temperatura.
CONCLUSÕES: Foi observado que o equipamento desenvolvido apresentou um resultado satisfatório, sendo a variação máxima de 0,30 unidades de pH. Esta variação é devido a resolução que se obtém com o software controlador, que utiliza apenas 8 dos 10 bits disponíveis para a conversão analógico-digital. A utilização de apenas 8 bits no conversor analógico-digital limita as leituras em valores múltiplos de 0,05 unidades de pH. Isto poderia ser melhorado utilizando os 10 bits disponíveis para conversão. Outra sugestão é a modificação do software, implementando uma rotina de calibração.
AGRADECIMENTOS: Á FACIT - Faculdade de Ciência e Tecnologia de Montes Claros, pelo apoio durante a execução do projeto
REFERÊNCIAS BIBLIOGRÁFICA: MEINRATH G. SPITZER P.(Uncertainties in determination of pH. Mikrochimica Acta 2000;135:155-68.)
BUCK PR. RONDININI S. COVINGTON KA. BAUCKE GKF. BRETT MAC. CAMÕES MF. MILTON JTM. MUSSINI T. NAUMAN R. PRATT WK. SPITZER P. WILSON SG.(Measurement of pH definition,standards and procedures. Internacional Union of Pure and Applied Chemistry.)Disponível em: http://www.iupac.org/publications/pac/2002/pdf/7411x 2169.pdf. Acesso em 17 jun. 2009.
