ÁREA: Química Analítica
TÍTULO: SÍNTESE E CARACTERIZAÇÃO DO MALONATO DE COBALTO (III) NO ESTADO SÓLIDO
AUTORES: CAIRES, J. F. (UNESP) ; LIMA, L. S. (UNESP) ; CARVALHO, C. T. (UNESP) ; DAMETTO, P. R. (UNESP) ; AMBROZINI, B. (UNESP) ; IONASHIRO, M. (UNESP)
RESUMO: Síntese, Caracterização, estabilidade térmica e decomposição térmica do CoCH2C2O4.2H2O foram investigados empregando termogravimetria e análise térmica diferencial simultânea (TG-DTA), calorimetria exploratória diferencial (DSC), espectroscopia de reflectância total atenuada na região do infravermelho, sistema TG-DTA-FTIR. A desidratação, bem como, a decomposição térmica do composto anidro ocorreu em uma única etapa. O resíduo final do malonato de cobalto em 340 ºC é Co3O4. Os resultados também forneceram informações a respeito denticidade do ligante, estabilidade térmica, comportamento térmico e identificação dos produtos gasosos liberados durante a decomposição térmica.
PALAVRAS CHAVES: metal de transição, malonatos, comportamento térmico
INTRODUÇÃO: Preparação e investigação de vários complexos de íons metálicos de malonatos no estado sólido têm sido investigados usando técnicas termoanalíticas e espectroscopia de infravermelho.
Os trabalhos publicados se referem a desidratação dos malonatos de metais alcalinos (MURAISHI, NAGASE, 1990), decomposição térmica do ácido malônico e malonatos de metais alcalinos (MURAISHI, 1990), análise TG-DTA do oxalato e malonato de európio (NAGASE et al., 1991), preparação e desidratação térmica do dicarboxilato de manganês(II) hidratado(SUZUKI, 1995), comportamento térmico dos malonatos de metais alcalinos terrosos (MURAISHI, SUZUKI, TAKAHASHI, 1996) e decomposição térmica dos malonatos de metais de transição (RANDHAWA; GANDOTRA, 2006). Em todos os trabalhos o estudo térmico foi realizado em atmosfera estática.
No presente trabalho foram sintetizados e estudados o malonato de cobalto, utilizando-se as técnicas termoanalíticas como termogravimetria e análise térmica diferencial simultânea (TG-DTA), calorimetria exploratória diferencial (DSC) e espectroscopia de absorção na região do infravermelho. O estudo térmico foi realizado em atmosfera dinâmica.
MATERIAL E MÉTODOS: As curvas TG-DTA foram obtidas no termoanalisador SDT 2960, da TA Instruments. A análise das amostras foram realizadas no intervalo de 30 – 1000 ºC, razão de aquecimento de 20 ºC min-1, atmosfera de ar seco, com fluxo de 100 mL min-1, cadinhos de α-alumina e massa da amostra da ordem de 7 mg.
A curva foi obtida no anlisador DSC Q10 da TA Instruments, com intervalo de 30 – 600 ºC, razão de aquecimento de 20 ºC min-1, atmosfera de ar seco com fluxo de 50 mL-1, cadinhos de alumínio com tampa perfurada e massa da amostra da ordem de 2 mg.
O espectro de absorção na região do infravermelho foi obtido com emprego do espectrofotrômetro Nicolet iS10 FT-IR , usando um acessório ATR com janela de Ge, com resolução de 4cm-1, na região de 4000 – 600 cm-1.
As medidas dos produtos gasosos foram realizadas usando um Thermogravimetric Analyzer Mettler TG-DTA acoplado a um FTIR spectrophotometer Nicolet com célula de gás e detector DTGS KBr. O forno e a célula aquecida (250 ºC) foram acoplados através de uma linha de transferência aquecida (200 ºC) de aço inoxidável de 120 cm de comprimento e 0,3 mm de diâmetro, ambos purgados com ar seco (50 ml min-1). Os espectros de FTIR foram registrados com 32 varreduras por espectro com resolução de 4 cm-1.
RESULTADOS E DISCUSSÃO: Pela análise do espectro na região do infravermelho constatou-se que a banda atribuída ao estiramento anti-simétrico do grupo carboxilato são deslocadas para valores mais baixos no malonato de cobalto (1562 cm-1) em relação a correspondente freqüência do grupo carboxilato do Na2CH2C2O4 (1582 cm-1). Este comportamento indica que a complexação é realizada através do grupo carbonílico [Nakamoto, 1997] e os dados do espectro de infravermelho sugere que a ligação do grupo carboxilato ao metal é quelatante bidentado [Deacon, 1980].
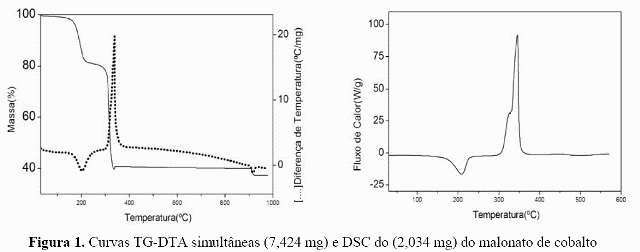
Curvas TG-DTA simultânea e DSC do malonato de cobalto são mostradas na Fig. 1. A primeira perda de massa ocorre entre 130 e 235 ºC (TG), correpondendo a um pico endotérmico em 205 ºC(DTA) ou 209 ºC (DSC) é devido a desidratação com perda de 2 H2O (Calc = 18,29 %, TG = 17,98 %). A decomposição térmica do composto anidro ocorre em uma única etapa entre 250 e 340 ºC com perda de 41,58 % correspondendo ao pico endotérmico em 340 ºC (DTA) ou 345 ºC com ombro em 328 ºC (DSC), atribuído a oxidação da matéria orgânica. A perda de massa total até 340 ºC está em acordo com a formação de Co3O4 (Calc. =59,26 %, TG = 59,56 %). A última perda de massa ocorre entre 905 e 925 Cº, correspondendo ao pico endotérmico em 915 º (DTA) atribuído a redução do Co3O4 para CoO (Calc. = 2,71 %, TG = 2,78 %) estando de acordo com a literatura.
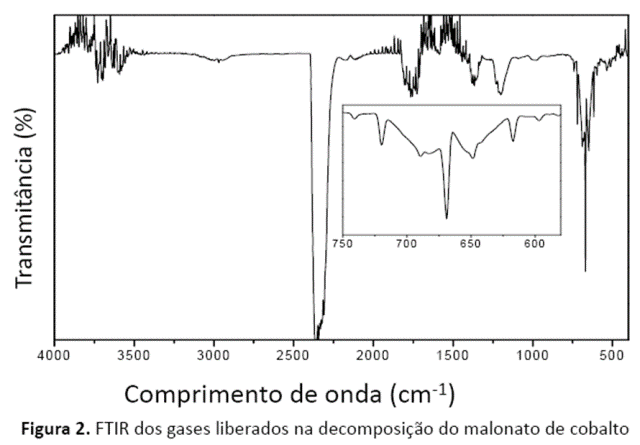
O espectro de infravermelho IR dos produtos gasosos eliminados durante a decomposição térmica do malonato de cobalto está mostrado na Fig. 2. Pela análise do espectro pode-se observar que a decomposição é acompanhada por pequenas reações paralelas com formação de novos produtos gasosos, pois foi identificado bandas referentes a grupos –CH2 além das bandas referentes a molécula de CO2.
CONCLUSÕES: A partir da curva TG foi estabelecido a formula do malonato de cobalto.
Os dados de espectroscopia na região do infravermelho sugerem que CH2C2O4 atua como um quelante bidentado ligando ao íon Co(II).
As curvas TG-DTA e DSC apresentadas anteriormente informam sobre a estabilidade térmica e decomposição térmica do malonato de cobalto em atmosfera dinâmica de ar
O monitoramento da libertação dos gases demonstrou que a decomposição térmica do malonato de cobalto ocorreu preferencialmente com a libertação de dióxido de carbono devido a descarboxilação e oxidação da matéria orgânica.
AGRADECIMENTOS: Os autores agradecem as fundações de apoio financeiro FAPESP, CNPq e CAPES.
REFERÊNCIAS BIBLIOGRÁFICA: MURAISHI, K. 1990. Thermal decomposition of alkali metal malonate anhydrides in various atmospheres. Thermochimica Acta 164: 401-409.
MURAISHI, K.; NAGASE, K. 1990. Thermal dehydration reactions of sodium(I), potassium(I), rubidium(I) and cesium(I) malonate hydrates in the solid state. Thermochimica Acta 159: 225-233.
MURAISHI, K.; SUZUKI, Y.; TAKAHASHI, Y. 1996. Thermal behavior of alkaline earth metal malonate hydrates and their anhydrides. Thermochimica Acta, 286: 187-198.
NAGASE, K.; YOKOBAYASHI, H.; MURAISHI, K.; KIKUCHI, M. 1991. Comparative studies between the thermal decomposition reactions of lanthanide(III) oxalates and malonates. Part I. The reaction processes of Eu2ox3.10H2O and Eu2mal3.6H2O. Thermochimica Acta, 177: 273-284.
RANDHAWA, B. S.; GANDOTRA, K. 2006. A comparative study on the thermal decomposition of some transition metal carboxylates. Journal of Thermal Analysis and Calorimetry, 85: 417-424.
SUZUKI, Y. 1995. Preparation and thermal dehydration of manganese(II) dicarboxylate hydrates. Thermochimica Acta, 255: 155-170.
