ÁREA: Química Analítica
TÍTULO: ESTUDO DO COMPORTAMENTO TÉRMICO DO MALONATO DE MANGANÊS E DE ZINCO
AUTORES: LIMA, L. S. (UNESP) ; CAIRES, J. F. (UNESP) ; CARVALHO, C. T. (UNESP) ; DAMETTO, P. R. (UNESP) ; AMBROZINI, B. (UNESP) ; IONASHIRO, M. (UNESP)
RESUMO: Caracterização, estabilidade térmica e decomposição térmica do MCH2C2O4.nH2O (onde M = Mn e Zn) foram investigados empregando termogravimetria e análise térmica diferencial simultânea (TG-DTA), calorimetria exploratória diferencial (DSC), espectroscopia de reflectância total atenuada na região do infravermelho.
PALAVRAS CHAVES: metal de transição, comportamento térmico.
INTRODUÇÃO: A preparação e investigação de vários complexos de íons metálicos de malonatos no estado sólido têm sido estudados usando técnicas termoanalíticas, difratometria de raios X e espectroscopia de infravermelho. Os trabalhos publicados se referem a desidratação dos malonatos de metais alcalinos (MURAISHI; NAGASE, 1990), decomposição térmica do ácido malónico e malonatos de metais alcalinos (MURAISHI, 1990), análise TG-DTA do oxalato e malonato de európio (NAGASE et al., 1991), preparação e desidratação térmica do dicarboxilato de manganês(II) hidratado (SUZUKI, 1995), comportamento térmico dos malonatos de metais alcalinos terrosos (MURAISHI; SUZUKI; TAKAHASHI, 1996) e decomposição térmica dos malonates de metais de trânsião(RANDHAWA; GANDOTRA, 2006). Em todos os trabalhos o estudo térmico foi realizado em atmosfera estática.
No presente trabalho foram sintetizados e estudados os malonatos de manganês e de zinco, utilizando-se as técnicas termoanalíticas como termogravimetria e análise térmica diferencial simultânea (TG-DTA), calorimetria exploratória diferencial (DSC) e espectroscopia de absorção na região do infravermelho. O estudo térmico foi realizado em atmosfera dinâmica.
MATERIAL E MÉTODOS: Carbonatos de Mn (II) and Zn (II) foram preparados adicionando lentamente, com continua agitação, solução de hidrogeno carbonato de sódio às soluções dos cloretos de manganês e zinco até total precipitação dos íons metálicos. Os precipitados obtidos foram filtrados em papel de filtro Whatman no 42, lavados com água destilada até a eliminação dos íons cloretos.
Os compostos de Mn (II) e de Zn (II), no estado sólido, foram preparados misturando os respectivos carbonatos mantidos em suspensão aquosa com ácido malônico em ligeiro excesso. As suspensões aquosas foram aquecidas lentamente até perto da ebulição e evaporadas à secura em banho-maria. Os compostos obtidos foram lavados com etanol, a fim de eliminar o ácido malônico em excesso, e depois de secos, foram mantidos em dessecador contendo cloreto de calico anidro.
As curvas TG-DTA foram obtidas no termoanalisador SDT 2960, da TA Instruments. A análise das amostras foram realizadas no intervalo de 30 – 1000 ºC, razão de aquecimento de
20 ºC min-1, atmosfera de ar seco, com fluxo de 100 mL min-1, cadinhos de α-alumina e massa da amostra da ordem de 7 mg.
A curva foi obtida no anlisador DSC Q10 da TA Instruments, com intervalo de
30 – 600 ºC, razão de aquecimento de 20 ºC min-1, atmosfera de ar seco com fluxo de 50 mL-1, cadinhos de alumínio com tampa perfurada e massa da amostra da ordem de 5 mg.
O espectro de absorção na região do infravermelho foi obtido com emprego do espectrofotrômetro Nicolet iS10 FT-IR , usando um acessório ATR com janela de Ge, com resolução de 4cm-1, na região de 4000 – 600 cm-1.
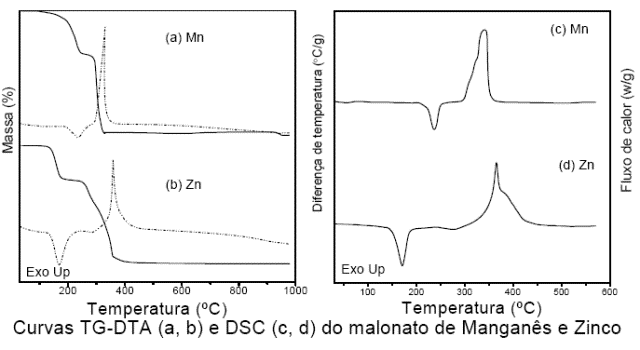
RESULTADOS E DISCUSSÃO: Curvas TG-DTA e DSC dos compostos são mostradas na Figura 1. No caso do manganês, a primeira perda de massa observada entre 100 e 255 ºC (TG), correspendente aos picos endotérmicos em 240 ºC (DTA) e em 238 ºC (DSC), é atribuída à desidratação com perda de 2,5 H2O (Calcd. = 22,30 %, TG = 22,14 %). A decomposição térmica do composto anidro ocorre em uma única etapa, entre 270 e 335 ºC, com perda de 39,95%, correspondendo aos picos exotérmicos em 335 ºC (DTA) e em 341 ºC (DSC) atribuídos à oxidação da matéria orgânica. A perda total de massa em até 335 ºC está em concordância com a formação de Mn3O4 (Calcd. = 62,25 %, TG = 62,45 %). A última perda de massa observada entre 920 e 955 ºC é atribuída a redução do Mn3O4 a MnO (Calcd. = 2.64 %, TG = 1.65 %) de acordo com a literatura (BIERNACKI; POKRZYWNICKI, 1999). No caso do zinco, a perda de massa observada entre 110 e 190 ºC (TG) correspendente aos picos endotérmicos em 170 ºC (DTA) e em 171 ºC (DSC), é atribuída à desidratação com perda de 2 H2O (Calcd. = 17,71 %, TG = 17,55 %). O composto anidro é estável até 230 ºC e entre 230 e 450 ºC ocorre a decomposição com perda de 42,70 %, correspondente aos picos exotérmicos em 355 ºC (DTA) e em 366 ºC (DSC) atribuídos à oxidação da matéria orgânica. O resíduo final obtido é ZnO.
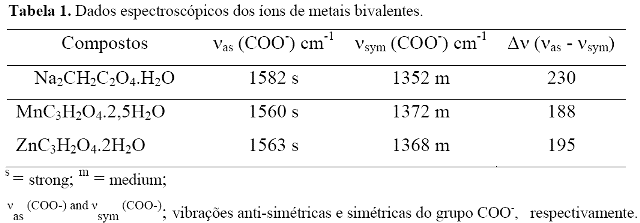
De acordo com a espectroscopia no infravermelho o grupo carboxilato pode se ligar ao metal (DEACON et. al., 1980) de três modos: unidentados, quelantes-bidentados e complexos em ponte. Essas comparações são obtidas a partir do sal do ligante∆ [νas (COO-) - νsim (COO-)] (Tabela 1) com os complexos metálicos. Nesse caso, como a diferença dos complexos de Mn(II) e Zn (II) para o sal é próxima sugere-se que os compostos estão ligados em ponte ao metal.
CONCLUSÕES: Os resultados das curvas TG-DTA forneceram informações sobre a estequiometria (MnC3H2O4.2,5H2O e ZnC3H2O4.2H2O), desidratação, estabilidade e decomposição térmica dos malonatos de manganês e zinco.
Com base na espectroscopia de absorção na região do infravermelho o íon carboxilato está coordenado ao metal em forma de ponte.
AGRADECIMENTOS: Fundações de fomento a pesquisa: CAPES, FAPESP e CNPq.
REFERÊNCIAS BIBLIOGRÁFICA: DEACON, G. B.; PHILLIPS, R. J. 1980. Relationships between the carbon-oxygen stretching frequencies of carboxylato complexes and the type of carboxylate coordination. Coord. Chem. Rev., 33: 227 – 250.
MURAISHI, K. 1990. Thermal decomposition of alkali metal malonate anhydrides in various atmospheres. Thermochimica Acta 164: 401-409.
MURAISHI, K.; NAGASE, K. 1990. Thermal dehydration reactions of sodium(I), potassium(I), rubidium(I) and cesium(I) malonate hydrates in the solid state. Thermochimica Acta 159: 225-233.
MURAISHI, K.; SUZUKI, Y.; TAKAHASHI, Y. 1996. Thermal behavior of alkaline earth metal malonate hydrates and their anhydrides. Thermochimica Acta, 286: 187-198.
NAGASE, K.; YOKOBAYASHI, H.; MURAISHI, K.; KIKUCHI, M. 1991. Comparative studies between the thermal decomposition reactions of lanthanide(III) oxalates and malonates.
