ÁREA: Química Analítica
TÍTULO: VALIDAÇÃO DE MÉTODO CROMATOGRÁFICO PARA ANÁLISE DE HORMÔNIOS ESTRÓGENOS EM ÁGUA POTÁVEL
AUTORES: VERBINNEN, R. T. (UFMA) ; NUNES, G. S. (UFMA) ; VIEIRA, E. M. (IQSC-USP)
RESUMO: Hormônios sexuais esteróides, naturais e sintéticos, são micropoluentes orgânicos que apresentam atividade de desregulação endócrina. O método analítico usou extração em fase sólida e CLAE-DAD, sendo validado conforme as orientações do guia para validação de métodos da ANVISA, adaptando-se para este estudo os procedimentos para os métodos bioanalíticos. Foram avaliadas as figuras de mérito analítico. O método foi linear na faixa de 1,25 a 7,50 µg L-1 para estriol e de 3,75 a 7,50 µg L-1 para 17β-estradiol, 17α-etinilestradiol e estrona, com r2 superiores a 0,98. As recuperações médias oscilaram de 73 a 104 %, com valores de DPR de 0,06 a 19,40 % e exatidão de 91,52 a 109,41 %. O método desenvolvido mostrou-se seletivo, linear, exato e preciso, sendo, portanto, considerado validado.
PALAVRAS CHAVES: validação. hormônios sexuais. água.
INTRODUÇÃO: O uso de águas superficiais para o consumo humano, e também como receptores de esgotos sanitários, tratados ou não, têm sido os principais motivos de preocupação acerca da contaminação das fontes de água (RODRIGUEZ-MOZAZ, ALDA e BARCELÓ, 2004). O estrógeno sintético 17α-etinilestradiol (EE2), amplamente usado na medicina em terapias de reposição e métodos contraceptivos, e os naturais estrona (E1), 17β-estradiol (E2) e estriol (E3) são considerados como responsáveis pela maioria dos efeitos desreguladores desencadeados pela disposição inadequada de esgoto sanitário (REIS FILHO, ARAÚJO e VIEIRA, 2006). Tendo em vista que E2 é o principal e mais potente estrogênio natural ovariano biologicamente ativo, seguido de seus metabólitos E1 e E3, respectivamente o segundo e o terceiro em potência de atividade; considerando que EE2 é o hormônio estrogênio sintético mais comumente usado em contraceptivos orais e o que possui maior persistência (JOHNSON e WILLIAMS, 2004); que há baixo índice de tratamento de esgotos no Brasil (REIS FILHO, BARREIRO, VIEIRA e CASS, 2007), e considerando ainda, o fato de que os tratamentos de água potável mais comuns são geralmente pouco eficientes na remoção destes poluentes (BILA e DEZOTTI, 2007), torna-se evidente a importância em se validar um método para análise destes químicos em água potável. No Brasil, níveis elevados de E2 e EE2, que chegaram a 2,51 e 0,31 µg L-1, respectivamente, foram determinados a jusante da cidade de Campinas, no Rio Atibaia que abastece 92% deste município (SODRÉ et al, 2007). O processo utilizado para confirmar que um método é confiável para a aplicação a que se propõe é denominado validação; portanto, é necessário para o reconhecimento das limitações e confiabilidade dos resultados obtidos (LOPES, 2007).
MATERIAL E MÉTODOS: Para análise de hormônios estrógenos em águas, dente outras técnicas, tem sido empregada a extração em fase sólida, para preparação de amostras, e a cromatografia a líquido de alta eficiência acoplada a detector de arranjo de diodos, para determinação (REIS FILHO, ARAÚJO e VIEIRA, 2006). Amostras de água potável e desionizada fortificadas com os quatro hormônios estrógenos e os parâmetros recomendados pela ANVISA para validação foram utilizados para o estabelecimento das condições cromatográficas e na determinação da curva de calibração, da recuperação, da precisão e do limite de detecção e quantificação do método. A aplicabilidade foi demonstrada utilizando-se os procedimentos analíticos e os parâmetros cromatográficos do método proposto, mediante a análise de amostras de água potável. O procedimento para validação do método analítico proposto neste estudo seguiu as orientações do “Guia para Validação de Métodos Analíticos e Bioanalíticos” publicado pela Agência Nacional de Vigilância Sanitária (ANVISA), optando-se por seguir as recomendações dos Métodos de Validação Bioanalíticos (AGÊNCIA NACIONAL..., 2003).
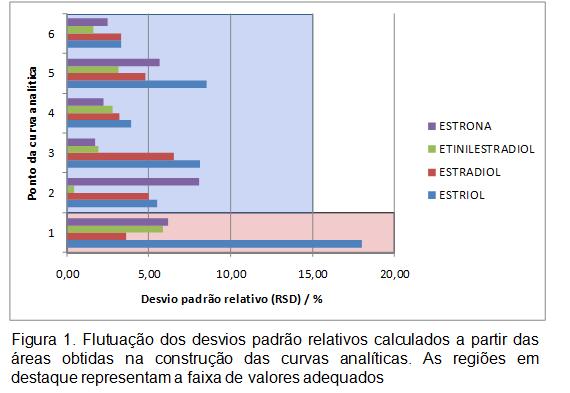
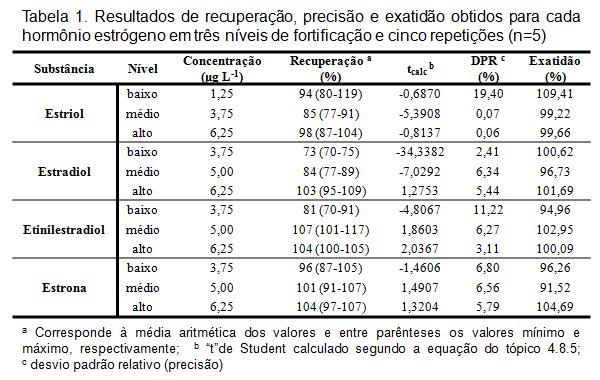
RESULTADOS E DISCUSSÃO: Os limites de detecção (LD) e inferior de quantificação (LIQ) do método foram determinados analisando-se a matriz contendo concentrações decrescentes do analito até o menor nível quantificável com precisão e exatidão aceitáveis. A precisão e a exatidão foram verificadas utilizando-se 3 concentrações (baixa, média e alta), contemplando a faixa linear dinâmica do procedimento. Estatisticamente, verificou-se a precisão calculando-se o DPR. No ensaio de recuperação, comparou-se os resultados analíticos de amostras fortificadas extraídas, com os obtidos a partir de soluções-padrão não extraídas. Para confirmar a exatidão do método, os resultados encontrados foram submetidos ao teste “t” de Student em nível de 95% de significância e n-1 graus de liberdade. Os valores encontrados para tcalc indicam que não há diferença estatisticamente significativa entre as recuperações obtidas e o valor desejado de 100%, já que todos eles são menores do que o ttab (2,132). Ademais, observando-se os valores para exatidão e DPR, é possível afirmar que o método desenvolvido é exato e preciso. O método foi linear na faixa de 1,25 a 7,50 µg L-1 (LD = 0,0625 µg L-1), para E3 e de 3,75 a 7,50 µg L-1 (LD = 1,25 µg L-1) para as demais substâncias. Os coeficientes de regressão linear (r2) resultaram em valores maiores que 0,98, e os DPRs de cada ponto das curvas de calibração também foram adequados (Figura 1). Tais resultados indicam que nesta faixa o método de separação cromatográfica é seguramente adequado para a determinação dos analitos de interesse. Na Tabela 1, são mostrados os resultados de recuperação, precisão e exatidão obtidos para cada estrogênio estudado.
CONCLUSÕES: O método desenvolvido foi considerado validado, após avaliação dos parâmetros: seletividade; linearidade; precisão; exatidão; limite inferior de quantificação; limite de detecção e recuperação, mostrando-se, portanto, seletivo, linear, exato e preciso. Os adequados valores obtidos para recuperação, precisão, exatidão e linearidade garantem a confiabilidade do método quando aplicado na determinação dos hormônios E2, EE2, E3 e E1 em água potável. Contudo, LD e LIQ precisam ser diminuídos ao nível de ng L-1, para garantir a determinação do menor nível capaz de causar transtornos aos organismos.
AGRADECIMENTOS: À CAPES e ao Prof. Dr. Vitor Pacces.
REFERÊNCIAS BIBLIOGRÁFICA: AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA. Determina a publicação do "Guia para validação de métodos analíticos e bioanalíticos"; fica revogada a Resolução RE nº 475, de 19 de março de 2002. Diário Oficial da União, Brasília, 2 jun. 2003. Disponível em: <http://e-legis.anvisa.gov.br/leisref/public/showAct.php?id=15132&word>. Acesso em: 25 nov. 2008.
BILA, D. M.; DEZOTTI, M. 2007. Desreguladores endócrinos no meio ambiente: efeitos e conseqüências. Química Nova, 30 (3): 651-666.
JOHNSON, A. C.; WILLIAMS, R. J. 2004. A model to estimate influent and effluent concentrations of estradiol, estrone, and ethinylestradiol at sewage treatment works. Environmental Science & Technology, 38 (13): 3649-3658.
LOPES, L. G. Estudo sobre a ocorrência de estrógenos em águas naturais e tratadas da região de Jaboticabal – SP. 2007. 121 f. Tese (Doutorado em Química) – Instituto de Química, Universidade Estadual Paulista: Araraquara, 2007.
SODRÉ, F. F. et al. 2007. Ocorrência de interferentes endócrinos e produtos farmacêuticos em águas superficiais da região de Campinas (SP, Brasil). J. Braz. Soc. Ecotoxicol, 2 (2): 187-196.
REIS FILHO, R. W.; ARAÚJO, J. C.; VIEIRA, E. M. 2006. Hormônios sexuais estrógenos: contaminantes bioativos. Química Nova, 29 (4): 817-822.
REIS FILHO, R. W.; BARREIRO, J. C.; VIEIRA, E. M.; CASS, Q. B. 2007. Fármacos, ETEs e corpos hídricos. Revista Ambi-Água, 2 (2): 54-61.
RODRIGUEZ-MOZAZ, S.; ALDA, M. J. L.; BARCELÓ, D. 2004. Monitoring of estrogens, pesticides and bisphenol A in natural waters and drinking water treatment plants by solid-phase extraction-liquid chromatography-mass spectrometry. Journal of Chromatography A, 1045: 85-92.
