ÁREA: Química Orgânica
TÍTULO: SÍNTESE DE delta-LACTONAS alfa,beta-INSATURADAS A PARTIR DE TELURETOS VÍNILICOS
AUTORES:FREITAS, J. C. R. (UFPE); DE OLIVEIRA, J. M. (UFPE) ; MENEZES, P. H. (UFPE)
RESUMO: Compostos de telúrio são importantes intermediários sintéticos e têm sido empregados na síntese de diversos produtos naturais. A reação de hidroteluração de acetilenos é freqüentemente o método mais aplicado para a preparação de teluretos vinilícos, devido à facilidade de obtenção dos materiais de partida, da régio- e estereosseletividade e da facilidade experimental da reação. Neste tocante o trabalho apresenta uma rota sintética eficiente para obtenção de delta-lactonas alfa,beta-insaturadas a partir de teluretos vínilicos, cujo rendimento global variou entre 41-58%.
PALAVRAS CHAVES: lactonas, telureto vílinico, hidroteluração
INTRODUÇÃO: A busca de respostas dos fenômenos da natureza é inato do ser humano, e para o químico orgânico a procura por rotas sintéticas eficientes e convergentes que permitam o acesso a estruturas químicas complexas é uma situação estimulante, pois exige dele dedicação, perspicácia e paciência. Neste sentido, diversos avanços têm sido realizados para a síntese de moléculas com elevado grau de complexidade estrutural.
Recentemente, uma nova classe de produtos naturais com interessantes atividades biológicas foi descrita. Entre estes compostos estão os derivados da 5,6-diidro-2H-piran-2-onas, dentre os quais destacam-se: Goniotalamina (ALI et al., 1997), Fostriecina (HOKANSON e FRENCH, 1985) e a Argentilactona (PRIESTAP et al., 1997).
Todas as lactonas mencionadas anteriormente apresentam grande importância farmacológica, e poucas metodologias são descritas para suas sínteses como, por exemplo, as metodologias baseadas na metátase de ligações duplas empregando o reagente de Grubbs (SCHWAB et al., 1996). Contudo, do ponto de vista sintético e econômico essas rotas apresentam mais etapas e os reagentes envolvidos são mais onerosos.
Neste contexto, a química de telúrio destaca-se, pois fornece intermediários que apresentam geometria Z, onde dependendo da rota sintética essa configuração pode ser retida, com custo baixo e de forma rápida. Assim, o trabalho apresenta uma rota sintética eficiente e convergente para produção de delta-lactonas alfa,beta-insaturadas, com ótimos rendimentos entre 80-86%, onde o principal intermediário o um telureto vínilico que é facialmente obtido através da reação de hidroteluração.
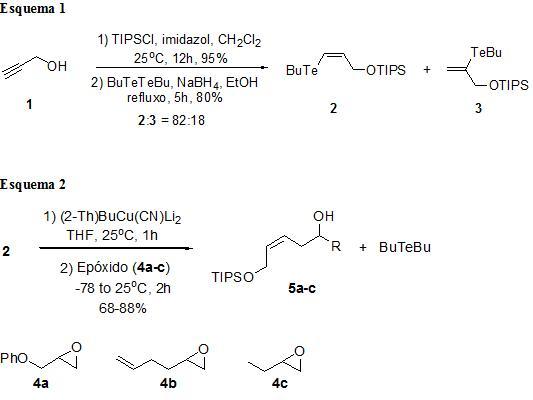
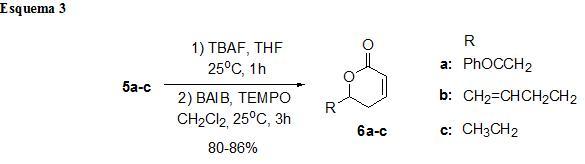
MATERIAL E MÉTODOS: Os reagentes e solventes foram obtidos através dos fornecedores Merck, Aldrich, Vetec e Cinética e quando necessário os solventes foram purificados de acordo com os métodos usuais (PERRIN et al., 1996). Os espectros de ressonância magnética nuclear de 1H e 13C foram obtidos e registrados em um Varian Unity Plus (300 MHz para o núcleo de hidrogênio e 75 MHz para o núcleo de carbono), utilizando clorofórmio deuterado (CDCl3) como solvente e tetrametilsilano (TMS) como padrão interno. Os espectros de infravermelho (IV) foram obtidos em espectrofotômetro de IV com Transformada de Fourier no instrumento Bruker Modelo IFS66. Os espectros de massas de baixa resolução foram realizados em aparelhos GCQ Finnigan e Shimadzu QP-5050A, operando com energia de ionização de 70 eV, hélio 4,5 como gás de arraste e uma coluna DB-5 de 30 m x 0,25 micrometro. A cromatografia em camada delgada (CCD) foi feita utilizando placas de sílica-gel contendo indicador fluorescente GF254 Merck. Para visualização das placas, utilizou-se luz ultravioleta, vapor de iodo e vanilina. A síntese iniciou-se com a reação de hidroteluração do álcool propargílico protegido com triisopropilsilano, fornecendo o telureto vinílico 2, seguido da reação de transmetalação via cianocuprato de ordem superior para uma posterior abertura de vários epóxidos 4a-c. Depois, foi realizado uma desproteção do composto 5a-c seguido de uma oxidação e ciclização para fornecer as delta-lactonas alfa,beta-insaturadas 6a-c.
RESULTADOS E DISCUSSÃO: A seqüência sintética foi iniciada a partir da proteção do álcool propargílico com cloreto de triisopropil silano (TIPSCl), pois em um estudo anterior, foi observado que o grupo protetor TIPS possui o tamanho ideal para levar a melhores regio-seletividades na reação de hidroteluração de alcoóis propargílicos (Trabalho de Dayvson). Desse modo, 1 foi transformado no éter de silício correspondente e submetido à reação de hidroteluração para levar aos regioisomeros 2 e 3 na proporção de 82:18 e em bom rendimento, os quais foram separados através de coluna cromatográfica (Esquema 1).
O telureto vinílico 2 foi submetido a reação de transmetalação, fornecendo um intermediário com retenção da geometria Z da dupla ligação. Para isso, o composto 2 foi tratado com um cianocuprato de ordem superior [2-ThBuCu(CN)Li2] – gerado in situ (LIPSHUTZ e SENGUPTA, 1992; POSNER, 1975; POSNER, 1972; MARINO et al., 1993). A posterior adição dos vários epóxidos levou a obtenção dos compostos 5a-c (Esquema 2) em um rendimentos entre 65-88%.
Os compostos 5a-c foram então submetidos à reação de desproteção pelo tratamento destes com uma solução 1M de TBAF em THF a temperatura ambiente durante 3 horas (AMANS et al., 2007). A reação foi acompanhada por TLC e ao consumo de todo material de partida o solvente foi evaporado e deu-se prosseguimento a etapa de lactonização. A etapa de lactonização foi realizada utilizado o sistema TEMPO/BAIB em CH2Cl2 de acordo com o procedimento descrito (YOU et al., 2006) para lactonização de 1,5-diois obtendo as delta-lactonas alfa,beta-insaturadas 6a-c com ótimos rendimentos entre 80-86% (Esquema 3).
CONCLUSÕES: Uma nova metodologia para a preparação de delta-lactonas alfa,beta-insaturadas foi descrita a partir de teluretos vinílicos, cujo o rendimento global variou entre 41-58%. A versão assimétrica da reação, bem como a sua aplicação na síntese de produtos naturais encontra-se em andamento em nosso laboratório.
AGRADECIMENTOS: Os autores agradecem ao CNPq e a UFPE/DQF.
REFERÊNCIAS BIBLIOGRÁFICA: ALI, A. M.; MACKEEN, M.M.; HAMID, M.; AUN, Q.B.; ZAUYAH, Y.; AZIMAHTOL, H.L.P.; KAWAZU, K. Planta Medica. 1997, 63, 81.
AMANS, D.; BELLOSTA, V.; COSSY, J. Org. Lett. 2007; 9, 4761-4764.
HOKANSON, G.C.; FRENCH, J.C. J. Org. Chem.1985, 50, 462.
LIPSHUTZ, B. H.; SENGUPTA, S., Org. React., 1992,41, 135.
MARINO, J.P.; TUCCI, F.C.; COMASSETO, J. V. Synlett 1993, 761.
PERRIN, D.L.; AMADOREGO, W. L.; PERRIN, D. R. “Purification of Laboratory Chemicals”, Pergamon Press, Oxford, 1996.
POSNER, G. H., Org. React. 1975, 22, 253.
POSNER, G. H., Org. React., 1972,19, 1.
PRIESTAP, H.A.; BONAFEDE, J.D.; RÚVEDA, E.A. Phytochemistry 1977, 16, 1579.
OLIVEIRA J. M.; PALMEIRA, D. J.; COMASSETO, J. V.; MENEZES, P.H. J. Braz. Chem. Soc. 2010, 21, 362.
SCHWAB, P.; GRUBBS, R.H.; ZILLER, J. W. J. Am. Chem. Soc. 1996, 118, 100.
YOU, Z-W.; JIANG,Z-X; WANG, B-L; QING, F-L J. Org. Chem. 2006, 71, 7261-7267.
