ÁREA: Química Orgânica
TÍTULO: SÍNTESE DE GLICOSÍDEOS 2,3-INSATURADOS CONTENDO COMO AGLICONA 1,2,4-OXADIAZOIS
AUTORES: DE FREITAS, J. J. R. (UFRPE) ; DE FREITAS FILHO, J. R. (UFRPE/UAG) ; SRIVASTAVA, R. M. (UFPE)
RESUMO: Neste trabalho descrevemos a síntese e determinação da configuração de glicosídeos 2,3-insaturados, utilizando os álcoois 3-aril-5-(2-hidroxi-2-etil)-1,2,4-oxadiazóis (Ar = fenil, p-toluil, m-toluil, o-toluil, p-clorofenil, p-bromofenil, p-metoxifenil, p-nirofenil, p-fluorfenil, p-benzilfenil) mediada por montmorillonita (K-10). A metodologia utilizada consistiu na reação de refluxo para obtenção dos novos 1,2,4-oxadiazóis seguida da reação de glicosidação do tri-O-acetil-D-glucal para fornecer os novos O-glicosídeos 2,3-insaturados com excelente rendimento. As estruturas desses glicosídeos foram elucidadas por espectroscopia de RMN 1H e 13C, infravermelho e por análise elementar.
PALAVRAS CHAVES: glicosídeos 2,3-insaturados, 1,2,4-oxadiazol, montmorillonita
INTRODUÇÃO: Dentre as áreas de estudo da síntese orgânica, a química de carboidratos, dos compostos heterocíclicos e dos compostos quirais têm despertado grande interesse por parte de pesquisadores por possibilitarem a obtenção de compostos biologicamente ativos. A literatura relata a existência de quatro trabalhos (TRONCHET et al., 1986, COTTIER et al., 1990, HENNEN e ROBINS, 1985, SRIVASTAVA et al, 2004) que descrevem compostos que contém o anel 1,2,4-oxadiazol ligado ao carboidrato (ribo, glico, alofuranose, 1,3-dioxolano e 1,2,4-oxadiazóis.). No caso dos glicosídeos 2,3-insaturado contendo os 1,2,4-oxadiazóis como aglicona, convém destacar que este produto foi obtido como uma mistura de diastereoisômeros os quais foram isolados por cromatografia em coluna e cujas estruturas foram elucidadas por difração de raio-X. Por outro, os 1,2,4-oxadiazóis são compostos importantes e muitos deles possuem diversas atividades farmacológicas (CLAPP, 1984). Diante do exposto, neste trabalho descrevemos a síntese e determinação da configuração de O-glicosídeos 2,3-insaturados obtidos por rearranjo de Ferrier, utilizando os álcoois 3-aril-5-(2-hidroxi-2-etil)-1,2,4-oxadiazóis (Ar =fenil, p-toluil, m-toluil, o-toluil, p-clorofenil, p-bromofenil, p-metoxifenil, p-nirofenil, p-fluorfenil, p-benzilfenil) e tri-O-acetil-D-glical.
MATERIAL E MÉTODOS: Em geral utilizou reagentes e solventes na sua forma comercial, P.A, sem nenhuma purificação adicional (a menos que seja mencionado) dos fornecedores: MERCK, VETEC, CINÉTICA. O acompanhamento das reações foi feito através de cromatografia em camada delgada (CCD), onde empregamos placas prontas de sílica-gel contendo indicador fluorescente F254 . O solvente usado para correr a placa foi CH2Cl2/AcOEt (9:1). Para visualização dos compostos usamos lâmpada de ultravioleta e/ou cuba contendo vapores de iodo. Para cromatografia em coluna utilizamos sílica-gel 60 (Merck, 70–230 mesh). Os espectros de RMN 1H foram obtidos em espectrofotômero VARIAN modelo Unity Plus (300 MHz), usando CDCl3 como solvente e tetrametilsilano como padrão interno. Espectros de infravermelho (IV) foram obtidos em espectrofotômetro de IV com Transformada de Fourier no instrumento BRUKER Modelo IFS66. A reação de obtenção dos 1,2,4-oxadiazóis foi realizada seguindo a seguinte metodologia: Em um balão de fundo redondo com condensador de refluxo e um Dean-Stark como armadilha, adicionou arilamidoxime (5 mmol) e éster (7,5 mmol). Em seguida foram dissolvidos em tolueno:DMF (9:1, v/v) (80 mL). Posteriormente o carbonato de potássio (6 mmol) foi adicionado. O conteúdo foi agitado sob refluxo, durante 8h. A reação foi diluída com acetato de etila (40 mL) e água (40 mL). A camada orgânica foi lavada com solução 1M de ácido clorídrico (40 ml), salmoura (40 mL) e secado com sulfato de sódio anidro. O solvente foi removido sob pressão reduzida e material bruto foi purificado por cristalização ou cromatografia de coluna.
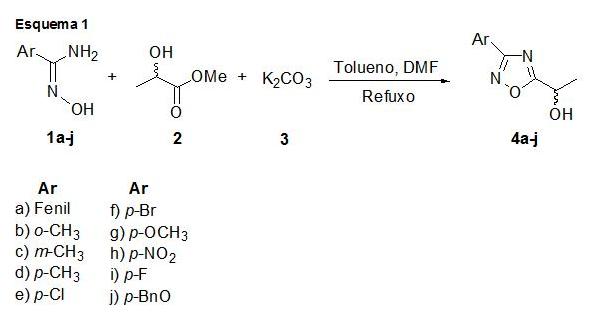
RESULTADOS E DISCUSSÃO: Para a síntese de glicosídeos 2,3-insaturados tendo como aglicona a função 1,2,4-oxadiazol, os produtos de partidas foram o tri-O-acetil-D-glucal e os álcoois 3-aril-5-(2-hidroxi-2-etil)-1,2,4-oxadiazóis (Ar =fenil, p-toluil, m-toluil, o-toluil, p-clorofenil, p-bromofenil, p-metoxifenil, p-nirofenil, p-fluorfenil, p-benzilfenil), preparados através da reação do lactato de metila (2) e arilamidoxime (1a-j) na presença de K2CO3, utilizando dimetilformamida (DMF) como catalisador, sobre refluxo com tempo de reação de 8 horas, conforme esquema 1. Os compostos 4a-j foram obtidos com bom rendimento.
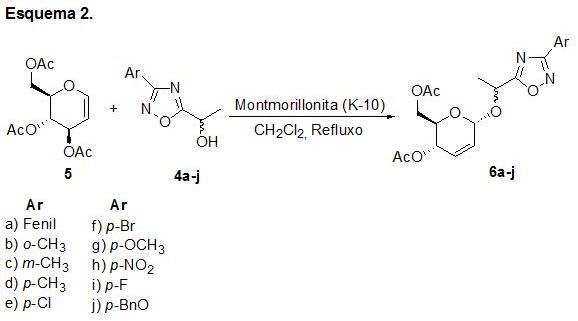
De posse dos álcoois 4a-j reagimos, o mesmo, com o tri-O-acetil-D-glical 5 (esquema 2) para fornecer os compostos 6a-j. Os compostos 6a-h foram obtidos com rendimento de 75-79%, após purificação por cromatografia em coluna usando sílica gel. As estruturas dos compostos foram elucidadas por espectroscopia RMN 1H e 13C, infravermelho e análise elementar.
Ao ser analisado os espectros de RMN 1H e 13C dos compostos 6a-j, percebe-se o desdobramento dos sinais da metila em na faixa de deslocamento δ 1,74-1,69 ppm. Este fato ocorreu, pois o composto sofreu racemização em umas das etapas de sua síntese. No espectro de RMN 1H percebe-se nitidamente a racemização, devido à metila da parte aglicona apareceu como dois dubleto na região de δ 1,74 ppm (J= 6,9 Hz) e δ 1,69 ppm (J=6,6 Hz). Ao constatar este fato foi realizado um estudo para descobri em que etapa tinha ocorrido a racemizado, uma vez que partimos de um álcool com estereoquímica já definida. Inicialmente foi realizada uma reação de glicosídação, entre o tri-O-acetil-D-glucal (1) e S-lactato de metila, cuja estereoquímica era conhecida, seguindo metodologia de TOSHIMA et al (1995).
CONCLUSÕES: Os álcoois 4a-j foram obtidos através da reação das arilamidoximas com o lactato de metila mediada por forno de microonda. Os compostos contendo na cadeia lateral a função 1,2,4-oxadiazol da parte aglicônica foram preparados inicialmente pelo rearranjo alílico do tri-O-acetil-D-glical, com o álcool 3-fenil-5-(2-hidroxi-2-etil)-1,2,4-oxadiazol fornecendo os compostos desejados, os quais foram purificados por cromatografia em coluna. As estruturas dos glicosídeos 2,3-insaturados 6a-j foram elucidadas por espectroscopia RMN 1H e RMN 13C, infravermelho e por análise elementar.
AGRADECIMENTOS: Os autores do trabalho agradecem a PIBIC/CNPq, pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: CLAPP, L. B. In “Comprehensive Heterociclic Chemistry”, KATRITZKY, A. R.; REES C. W. (Eds.), Pergaman Press, 1984, 6, 365. OBS: E as referências citadas nele.
COTTIER, L.; FAURE, R.; DESCOTES, G.; SRIVASTAVA, R. M. Heterocycles. 1990, 31, 230.
HENNEN, W. J.; ROBINS, R. K. J. Heterocycl. 1985, 22, 1747.
TRONCHET, J. M.; ZOSIMO-HONDOLFO, G.; BERNARDINELLI, G.; ARRIZABALAGA, P.; GEOFFROY, M. J. Carbohydr. Chem. 1986, 5, 631.
SRIVASTAVA, R. M.; DE FREITAS FILHO, J. R.; DA SILVA, M. J.; DE MELO SOUTO, S. C.; CARPENTER, G. B.; FAUSTINO, W. M. Tetrahedron. 2004, 60, 10761.
TOSHIMA, K.; ISHIZUKA, T.; MATSUO, G.; NAKATA, M. Synlett, 1995, 306.
