ÁREA: Química Inorgânica
TÍTULO: Síntese e caracterização dos complexos de Ln(III) com líquido iônico 1-n-butil-3-metilimidazol
AUTORES: BORGES, A.S (UFMG) ; ARAÚJO, M.H (UFMG) ; AYALA, J.D (UFMG)
RESUMO: A síntese e o estudo do comportamento térmico dos complexos de 2,4,6-trinitrofenolato
de lantanídeos(III) contendo como contra-íon o 1-n-butil-3-metilimidazol foi discutida
neste trabalho. A análise das curvas TG, a sua primeira derivada (DTG) e DTA, obtidas
em um equipamento TGA/DTA-60 Shimadzu, mostram que os compostos de
coordenação,(BMIM)3[Ln(pic)6] (BMIM = 1-n-butil-3-metilimidazol; Ln = Nd3+, Sm3+, Gd3+,
pic = 2,4,6-trinitrofenolato), em atmosfera dinâmica de ar (100mL.mim-1) apresentam
três etapas de decomposição térmica, sendo cada uma delas exotérmica e o resíduo obtido
a 800ºC são os respectivos Ln2O3, caracterizados por raios-X (método do pó).
PALAVRAS CHAVES: líquido iônico, lantanídeos(iii), análise térmica
INTRODUÇÃO: Os Líquidos iônicos são definidos como líquidos eletrolíticos constituídos apenas de
íons e possuem temperaturas de fusão abaixo de 100oC. Seu uso como solvente na
química orgânica é hoje muito difundido. Com o surgimento da Química Verde e a
preocupação com o meio ambiente e a saúde humana o uso dos solventes verdes tornou-se
cada vez mais comum e suas aplicações estão sendo cada vez mais exploradas pelos
grupos de pesquisa em todo mundo. Algumas propriedades dos líquidos iônicos, tais
como a elevada solubilidade, janela eletroquímica larga e pressão de vapor
desprezível são responsáveis pela sua aplicação na indústria. Devido, principalmente,
as suas propriedades espectroscópicas e magnéticas os compostos de lantanídeos são
extremamente utilizados, destacando-se seu uso na siderúrgia, como aditivo para
tratamento do aço, na indústria de vidro (fabricação de lentes oftálmicas, óculos
escuros, vidros especiais, telas de TV e computadores), como catalisadores
(tratamento de emissões automotivas e em processos de craqueamento de frações do
petróleo), como imãs permanentes (fabricação de motores, relógios, transporte e
memória de computadores, sensores, microfones); na medicina (como agente de contraste
em diagnóstico não invasivo de patologias em tecidos, por imagem de ressonância
magnética nuclear (RMN)); como laser para espectroscopia, micro-soldas entre outras.
Um novo ramo de pesquisa com lantanídeos vem surgindo com a formação de seus
complexos, com o objetivo de aproveitarem as propriedades tanto dos
lantanídeos como a dos líquidos iônicos. A aplicação em catálise, em processos
eletroquímicos incluindo eletrodeposição, baterias e células solares, e em estudos de
propriedades luminescentes e magnéticas vem sendo investigadas.
MATERIAL E MÉTODOS: O 1-metilimidazol (Aldrich) foi purificados por destilação com uma pequena quantidade
de KOH. A Acetonitrila (Vetec) foi seca através de destilação com uma pequena
quantidade de P2O5. O ácido 2,4,6-trinitrofenólico (nuclear), diclorometano (Vetec) e
o bromo-butano (Aldrich) foram usados como recebidos. Os Ln2O3 foram adquiridos da
Strem Chemical Inc. O 1-n-butil-3-metilimidazol (BMIM-Br) foi preparado em atmosfera
de argônio, enquanto o BMIM-pic foi preparado em sistema aberto, assim como a reação
para a formação do complexo. Os espectros de absorção na região do infravermelho dos
líquidos iônicos, dos complexos e dos resíduos da TG a 800ºC, foram obtidos pela
técnica em pastilhas de KBr na região de 4500 a 370 cm-1, utilizando um
espectrofotômetro da Perkin Elmer FTIR GX, à temperatura ambiente. As curvas TG/DTG e
DTA foram registradas em uma termobalança TGA/DTA-60 da Shimadzu, com aproximadamente
1,2 mg de amostra em cadinho de alumina, na faixa de temperatura de 25 a 800ºC , com
razão de aquecimento de 10ºC.min-1 sob atmosfera dinâmica de ar (100mL.mim-1). Os
resíduos da TG foram analisado por raios-X (método do pó), através de um difratômetro
de raios-X Rigaku, modelo Geigerflex, com tubo de Cu, utilizando-se uma radiação
CuKalfa1(1,5406 angstron).
RESULTADOS E DISCUSSÃO: O líquido iônico (BMIM-Br) foi sintetizado conforme(DUPONT et al.,2003). O BMIM-pic
foi preparado por extração com diclorometano a partir da solução aquosa do BMIM-Br
com o 2,4,6-trinitrofenolato de potássio. A solução do líquido iônico BMIM-pic foi
lavada três vezes com água deionizada, e após a evaporação do solvente (CH2Cl2), os
produtos foram secos sob vácuo a 50°C por 12h(80% de rendimento). Foi realizada a
reação entre os óxidos de lantanídeos(III) e o ácido 2,4,6-trinitrofenólico em
solução aquosa, obtendo-se Ln(pic)3.xH2O. Estes compostos reagiram com BMIM-
pic em acetonitrila e obteve-se o complexos de fórmula geral:(BMIM)3[Ln(Pic)6]. A
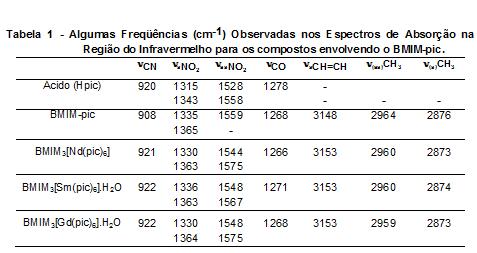
Tabela 1 apresenta as bandas dos espectros de absorção na região de IV do ácido
2,4,6-trinitrofenólico, do BMIM-pic e dos complexos. O deslocamento dos estiramentos
simétrico e assimétrico do grupo nitro (-NO2) para regiões de maiores números de
ondas, quando comparamos o ácido com os complexos, sugere que o ânion
trinitrofenolato se coordena aos íons lantanídeos de forma bidentada através do
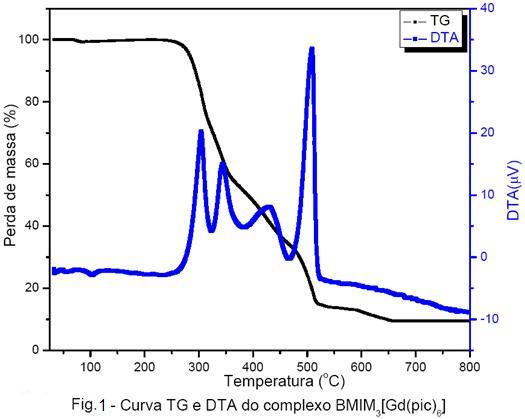
oxigênio fenólico e um dos oxigênios do grupo -NO2 adjacente. A análise das curvas
TG/DTG e DTA dos complexos, mostraram que os compostos são estáveis até temperaturas
próximas a 250ºC e possuem quatro etapas de decomposição térmica, sendo cada
uma delas exotérmica(Fig.2).
CONCLUSÕES: A síntese dos complexos de 2,4,6-trinitrofenolato de Ln(III) com o 1-n-butil-3-
metilimidazol, são inéditos. Estes complexos são estáveis até 250ºC e a decomposição
térmica ocorre em quatro etapas exotérmicas, sendo o resíduo a 800ºC caracterizado como
Ln2O3 (Ln= Nd,Sm e Gd). As informações dos espectros de absorção na região do
infravermelho sugerem que a coordenação aos íons lantanídeos(III) ocorreram através
do grupo fenólico e de um grupo nitro do ânion 2,4,6-trinitrofenolato de uma maneira
bidentada. As soluções dos complexos de lantanídeos têm grande potencial para
eletrodeposição.
AGRADECIMENTOS: CNPq, FAPEMIG, UFMG
REFERÊNCIAS BIBLIOGRÁFICA: 1- Santos, S. C.; Rivera-Rubero, S.; Dibrov, S.; Baldelli, S. J. Phys. Chem. C 2007, 111, 7682-7691
2- Silva, F. M.; Lacerda; P. S. B.; Junior, J. J. Quim. Nova 2005, 28, 103-110
3- Martins, T. S.; Paulo Celso Isolani, P. C. Quim. Nova 2005, 28, 111-117
4- Dupont, J.; Consorti,C. S.; Suarez, P. AZ.; Souza, R. F. Organic Syntheses 2004, 10, 184; 2002, 79, 236.
5- Yun, S. S.; Kang, S. K.; Suh, H. R.; Suh, H. S.; Lee, E. K.; Kim, J. K.; Kim, C. H. Bulletin of the Korean Chemical Society 2005, 26, 1197-1202.
6- Yan, Z-Z; Tang, Y.; Liu, W-S; Cui, H-X; Tan, M-Y J Fluoresc 2008 18,473–478
7- Lima, R. D.; Afonso, J. C.; Pimentel, L. C. F. Quimica Nova 2009, 32, 263-270
