ÁREA: Química Inorgânica
TÍTULO: Estabilidade térmica e eletroquímica dos líquidos iônicos 2,4,6-trinitrofenolato imidazólicos
AUTORES: BORGES, A.S (UFMG) ; ARAÚJO, M.H (UFMG) ; AYALA, J.D (UFMG)
RESUMO: Neste trabalho relatamos a estabilidade térmica e eletroquímica dos líquidos iônicos:
2,4,6-trinitrofenolato de 1-etil-3-metilimidazol ([EMIM]+ [pic]-), 2,4,6-
trinitrofenolato de 1-n-butil-3-metilimidazol ([BMIM]+[pic-]), 2,4,6-trinitrofenolato
de 1-n-butil-3-etilimidazol ([BEIM]+[pic]-) e 2,4,6-trinitrofenolato de 1,3 di-n-
butilimidazol ([BBIM]+ [pic]-). O trabalho foi iniciado com a síntese dos brometos
imidazólicos e em seguida foi realizada a troca iônica para o íon 2,4,6-
trinitrofenolato e posteriormente a caracterização através dos espectros de RMN de 1H e
13C e dos espectros de absorção na região do infravermelho. A estabilidade térmica foi
analisada através das curvas TGA e DTA e a estabilidade eletroquímica através da
voltametria cíclica (CV).
PALAVRAS CHAVES: líquido iônico, 2,4,6-trinitrofenolato, imidazol
INTRODUÇÃO: Líquidos iônicos (LIs) são sais com baixo ponto de fusão sendo, em muitos casos,
líquidos à temperatura ambiente. São sistemas de grande importância por seus diversos
usos em importantes áreas da química, sendo normalmente empregados em extração,
reações de síntese, em catálise e em processos eletroquímicos. Os principais LI são
aqueles contendo cátions baseados no anel imidazólio ou piridínio.
Apresentam inúmeras vantagens quando comparados aos solventes orgânicos
convencionais, determinados pela combinação original de suas propriedades: baixo
ponto de fusão; composição iônica apresentando uma alta dissociação iônica, embora
muitas vezes sejam citados como líquidos fortemente estruturados; condutores de
eletricidade; pressão de vapor extremamente baixa; grande variação de suas
propriedades fisico-químicas como uma função da sua estrutura, formando ampla classe
de solventes fortemente polares, com a sua polaridade variando entre acetronitrila e
metanol e presença de ligações de hidrogênio. São versáteis, pois dissolvem
tanto compostos orgânicos como inorgânicos e são, também, mais fáceis de trabalhar do
que sais fundidos. A utilização de líquidos iônicos está de acordo com
os princípios da química verde, que visa processos químicos ambientalmente mais
limpos e seletivos, e tendo como uma das preocupações a substituição de solventes
orgânicos, especialmente os organo-halogenados. Devido às suas propriedades, abriram-
se diversas perspectivas promissoras para eles em diversas áreas da química,
aumentando significativamente os trabalhos na área. Entretanto, devido ao caráter
aplicado das pesquisas, estudos fundamentais sobre estes ainda são necessários.
O ânion 2,4,6-trinitrofenolato com cátions imidazólicos vem sendo pesquisado pelo
nosso grupo.
MATERIAL E MÉTODOS: Foram adquiridos da Aldrich o bromo-etano e o 1-bromo-butano e utilizados como
recebidos. O 1-metilimidazol e o 1-butilimidazol, também da Aldrich foram
purificados por destilação com uma pequena quantidade de KOH. A Acetonitrila (synt)
foi seca através de destilação com uma pequena quantidade de P2O5. O 2,4,6-
trinitrofenolato de potássio (acros) utilizado para a troca iônica foi usado como
recebido, assim como o diclorometano (Vetec).
A pureza dos líquidos iônicos BMIM-Pic, EMIM-Pic, BEIM-Pic, BBIM-pic foram
determinadas por RMN 1H e 13C (Os espectros foram obtidos no espectrômetro de RMN
avance DPX200, utilizando como referência interna tetrametilsilano (TMS) e o solvente
utilizado foi o clorofórmio deuterado) e por espectros de absorção na região do
infravermelho (obtidos em pastilhas de KBr na região de 4500 a 370 cm-1, utilizando
um espectrofotômetro da PerkinElmer FTIR GX, à temperatura ambiente). As curvas
TG/DTG e DTA foram obtidas em uma termobalança TGA/DTA-60 da Shimadzu e massa
aproximadamente de 1,5 mg de amostra em cadinho de alumina, numa faixa de temperatura
de 20 à 800ºC. Utilizou-se uma razão de aquecimento de 10ºC.min-1 sob atmosfera
dinâmica de ar com vazão de 100mL.min-1. A cela para a realização da voltametria
cíclica foi composta de três eletrodos (eletrodo de trabalho, referência e auxiliar).
O eletrodo auxiliar é constituído de Pt com 10,0 cm2 de área exposta. O eletrodo de
referência é constituído da Ag/AgCl saturado e o eletrodo de trabalho é constituído
de Pt com 1cm2. A distância entre o eletrodo de trabalho e os eletrodos de referência
e auxiliar foi de 2 mm.
RESULTADOS E DISCUSSÃO: Os líquidos iônicos formados pelos brometos foram sintetizados conforme (DUPONT et
al., 2003). Os líquidos iônicos formado por 2,4,6-trinitrofenolato foram preparados
por extração com diclorometano a partir das soluções aquosa dos sais de brometo
imidazólicos. As soluções de diclorometano foram lavadas três vezes com água
deionizada. O solvente foi removido das soluções a pressão reduzida e os sólidos
foram armazenados em um dessecador sobre P2O5. A presença do grupo 2,4,6-
trinitrofenolato na estrutura dos líquidos iônicos foi confirmada pela observação do
simpleto em 8.84 ppm para o EMIM-Pic, 8.80 ppm para o BMIM-Pic, 8,71 ppm para o BEIM-
Pic e 8,78 ppm para o BBIM-pic nos espectros de RMN de 1H atribuído aos hidrogênios
aromático do ânion 2,4,6-trinitrofenolato. A presença do íon 2,4,6-trinitrofenolato
também foi evidenciada no espectro de absorção na região do infravermelho, onde foi
observada as bandas de estiramento assimétrico em 1559 cm-1 e estiramento simétrico
em 1365 cm-1 e 1335 cm-1 para o grupo -NO2 e a banda em 1269 cm-1 referente a
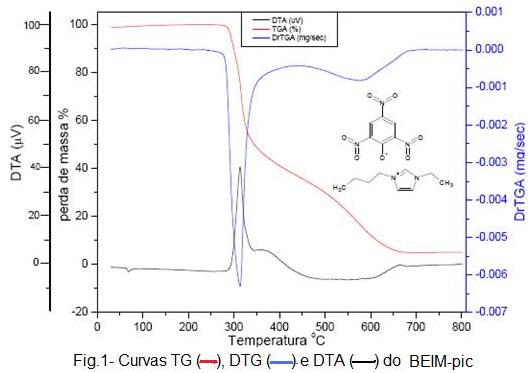
estiramento CO do anel 2,4,6-trinitrofenolato. A perda de massa dos líquidos iônicos
é semelhante, ocorrendo o início da decomposição térmica a 225ºC para o EMIM-Pic,
276ºC para o BEIM-Pic (Figura-1), 227ºC para o BMIM-Pic e 288ºC para o BBIM-pic. O
evento endotérmico foi atribuído a fusão dos líquidos iônicos, uma vez que não se
observa perda de massa. Os eventos exotérmicos observado após a fusão foi
atribuído à oxidação da matéria orgânica durante o processo de decomposição. A
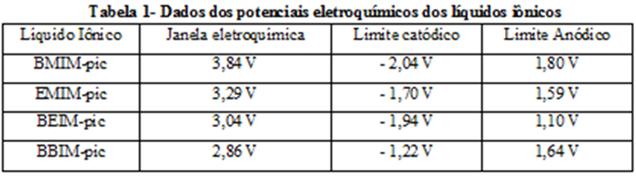
Tabela-1 apresenta o limite de potencial positivo (atribuído a oxidação do ânion
2,4,6-trinitrofenolato), o limite de potencial negativo (atribuído a redução dos
cátions imidazólicos) e a janela eletroquímica dos líquidos iônicos.
CONCLUSÕES: O conhecimento da estabilidade térmica e eletroquímica dos 2,4,6-trinitrofenolato
imidazólicos, abre a possibilidades de estudar aplicação destes em catálise homogênea e
heterogênea, ramo de pesquisa tanto dos químicos orgânicos como dos inorgânicos, como
solventes para eletrodeposição de metais, além do estudo de formação de complexos
metálicos. Os líquidos iônicos mostraram-se estáveis a temperaturas acima de 220ºC e
apresentaram janela eletroquímica de 2,86 V para o BBIM-pic, 3,04 V para o BEIM-pic,
3,29 V para o EMIM-pic e 3,84 V para o BMIM-pic.
AGRADECIMENTOS: CNPq, FAPEMIG, UFMG
REFERÊNCIAS BIBLIOGRÁFICA: 1- Dupont, J., Consorti, C. S., Suarez, P. A., Souza, R. F. Org.Synth. Preparation of 1-butyl-3-methyl imidazolium-based room temperature ionic liquids. 79 (2003) 236.
2- El Seoud, O. A., Pires, P. A. R., Abdel-Moghny, T., Bastos, E. L. J. Colloid Interface Sci. Synthesis and micellar properties of surface-active ionic liquids: 1-Alkyl-3-methylimidazolium chlorides. 313 (2007) 296.
3- Dupont, J.; Consorti,C. S.; Suarez, P. AZ.; Souza, R. F. Organic Syntheses 2004, 10, 184; 2002, 79, 236.
4- Yun, S. S.; Kang, S. K.; Suh, H. R.; Suh, H. S.; Lee, E. K.; Kim, J. K.; Kim, C. H. Bulletin of the Korean Chemical Society 2005, 26, 1197-1202.
5- Yan, Z-Z; Tang, Y.; Liu, W-S; Cui, H-X; Tan, M-Y J Fluoresc 2008 18,473–478
6- Lima, R. D.; Afonso, J. C.; Pimentel, L. C. F. Quimica Nova 2009, 32, 263-270
