ÁREA: Físico-Química
TÍTULO: Estudo teórico do mecanismo de obtenção do Biodiesel via catálise ácida.
AUTORES: ZARAMELLO, L. (UFSC) ; SOUSA JR, P.T. (UFMT) ; DALL'OGLIO, E.L. (UFMT) ; KUHNEN, C.K. (UFSC)
RESUMO: A transesterificação do triglicerídeo do ácido butírico foi estudada teoricamente empregando a Teoria do Funcional da Densidade (DFT). Os resultados obtidos mostram que a reação procede por meio de um mecanismo do tipo SN2, com um único estado de transição para cada passo da reação (mecanismo concertado). Foram avaliadas também as ordens de ataque do nucleófilo à cadeia do triglicerídeo, mostrando que há certa competição entre as seqüências de ataque, no entanto o mecanismo que procede por ataque primeiramente à carbonila central e posteriores ataques às carbonilas das pontas, apresenta menor custo energético sendo o mecanismo sugerido para essa reação.
PALAVRAS CHAVES: catálise ácida, biodiesel, cálculos dft.
INTRODUÇÃO: A grande demanda energética para suprir as necessidades da sociedade atual nos obriga a cada vez mais buscar fontes alternativas de energia, assim energias geradas a partir de fontes renováveis, “energias limpas”, vem sendo objeto de crescentes estudos e aprimoramento para reduzir o uso, ou mesmo substituir as fontes energéticas atuais.
O biodiesel já vem ocupando espaço na matriz energética brasileira desde 2008 com início do B2 (adição 2% de Biodiesel ao Diesel). Atualmente utiliza-se para produção base forte (KOH ou NaOH) como catalisador e metanol como nucleófilo e solvente. Porém esta reação exige uma certa qualidade da matéria prima, para evitar reações paralelas como a de saponificação.
Catalisadores ácidos, objeto de estudo deste trabalho, são ambientalmente corretos e permitem a utilização de matérias primas de baixa qualidade. Cálculos utilizando o funcional de Densidade (DFT) foram efetuados para modelar este mecanismo, a fim de analisar como a reação procede. Devido a complexidade do sistema, o estudo foi realizado com um triglicerídeo de quatro carbonos (TAG), baseado no fato que o tamanho da cadeia afeta muito pouco os valores das barreiras energéticas. (AZAKUMA et al., 2009).
O mecanismo da transesterificação do triglicerídeo do ácido butírico consiste em três etapas:
• Ataque do nucleófilo ao TAG formando diglicerídeo (DAG) e uma molécula de biodiesel (BD)
• Ataque do nucleófilo ao DAG formando monoglicerídeo (MAG) + BD
• Ultimo ataque do nucleófilo ao MAG formando a glicerina + BD
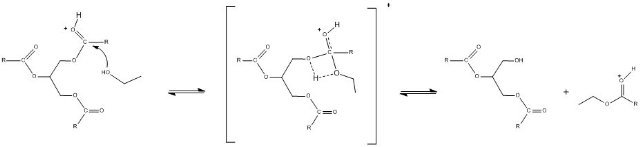
Neste estudo avaliamos a possibilidade de ataque em três posições (carbonilas) diferentes, conforme mostra a Figura 1, originando três distintas seqüências de ataques onde estudamos as barreiras energéticas para os seguintes Sistemas: 123, 321 e 132.
MATERIAL E MÉTODOS: Todos os cálculos foram efetuados usando o programa Gaussian03 (POPLE, et al.,2003) no cluster “Minerva” do Departamento de Física da USFC. O sistema em estudo é bastante complexo, sendo que um TAG do acido oléico (C18) de fórmula molecular C57H110O6 possui cerca de 500 elétrons, e questões relacionadas a memória, espaço em disco e o tempo computacional crescem com alguma potência de N (N2, N4) onde N é o número total de funções de base envolvidas no cálculo e que depende tanto do tamanho do sistema molecular como do conjunto de funções escolhido. Desta forma é mais conveniente trabalhar com a molécula reduzida, o triglicerídeo do acido butírico, que reproduz muitíssimo bem o sistema em estudo, uma vez que o tamanho da cadeia tem efeito desprezível nas barreiras energéticas. (AZAKUMA et al., 2009).
Todas as geometrias foram otimizadas com conjunto de funções de base B3LYP/6-31G(2d,p), os estados de transição (TS) encontrados foram confirmados via cálculos de frequência, e cálculos da coordenada intrínseca de reação (IRC) foram efetuados conectando desta forma os dois mínimos locais mais próximos da geometria do TS.
RESULTADOS E DISCUSSÃO: Foi obtido um único estado de transição do tipo SN2, mecanismo concertado, para cada etapa, onde o ataque do nucleófilo leva a formação dos produtos de forma direta, (Figura 1). Não foi encontrado intermediário tetraédrico como geralmente é proposto na literatura (CAREY, 2007). Resultado este reforçado por estudos de reação semelhante onde o intermediário tetraédrico não é encontrado como um mínimo na superfície de energia (WILBUR et al., 1994).
A análise de ordens de ligação, nas geometrias do TS’s mostra que há mais quebra do que formação de ligações, o que caracteriza um TS do tipo “explodido” (JENCKS, 1980). Os TS’s em cada caso mostram a mesma tendência com valores muito próximos de grau de quebra e formação de ligação, sendo 42% de quebra da ligação C-Ogli, 56% de quebra da ligação H-OEt, e 60% de formação da ligação entre o oxigênio nucleófilo e o carbono carbonílico.
Foram obtidas as diferenças nas barreiras energéticas (Figura 2) de acordo com a seqüência de ataque do nucleófilo, que pode proceder em três diferentes ataques sucessivos (FREEDMAN et al., 1986).
Como se mostra na figura 2 os valores das barreiras energéticas variam entre 18,31 e 45,4 kcal/mol sendo que os menores valores obtidos são para a primeira e segunda etapa do sistema 321, 42,23 e 18,31 kcal/mol respectivamente. Indicando que esta é a seqüência de ataque que leva a formação dos produtos.
Dados experimentais (FREDMAN et al., 1986) mostram que a primeira etapa da reação tem custo energético de 14,9 kcal/mol. Esta diferença pode ser explicada pelo uso de um conjunto de funções de base relativamente pequeno, pela falta de inclusão de moléculas do solvente de maneira explícita e pela falta de inclusão de modelos de solvatação.
CONCLUSÕES: Os resultados obtidos via cálculos DFT mostram a existência de um único estado de transição, do tipo explodido, para cada etapa da reação, uma vez que por meio da análise das ordens de ligação verificou-se que há mais quebra do que formação de ligações na geometria do TS.
A análise das diferentes maneiras que a reação pode ocorrer, segundo a posição de ataque do nucleófilo, sugere que o mecanismo procede via ataque à carbonila central, seguido de sucessivos ataques às carbonilas das pontas, pois este é o caminho que possui um menor custo energético.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: ASAKUMA,Y.; MAEDA, K.; KURAMOCHI, H.; FUKUI, K. Fuel 2009, 88, 786.
CAREY, F. A.; SUNDBERG, R. J. Advanced Organic Chemistry; Springer Verlag: New York, 2007; 5th ed, pp 253-272.
POPLE J. A. et al., Gaussian 03, Revision B.03, Gaussian, Inc. Pittsburgh PA, 2003.
JENCKS, W. P. Acc. Chem. Res. 1980, 13, 161.
WILBUR, J. L.; BRAUMAN, J. I. J. Am. Chem. Soc. 1994, 116, 5839.
FREEDMAN, B.; BUTTERFIELD, R.O.; PRYDE, E.H. J. Am. Oil Chem. Soc. 1986, 63, 1375.
FREEDMAN, B.; PRYDE, E.H.; MOUNTS, T.L. J. Am. Oil Chem. Soc. 1984, 61, 1638.
