ÁREA: Ambiental
TÍTULO: FRACIONAMENTO QUÍMICO DE ÓXIDOS DE FERRO EM SOLOS
AUTORES: CORINGA, E. A. O. (IFMT) ; GORGONHA, E. N. (IFMT) ; COUTO, E. G. (UFMT) ; OTERO, X. L. (USC - ESPANH)
RESUMO: O objetivo deste trabalho foi determinar os tipos de óxidos de ferro presentes em solos representativos do Pantanal do Mato Grosso. Os óxidos de ferro exercem um papel relevante em solos, como na relação solo-planta, como indicadores dos processos de pedogenêse, e como critério auxiliar de agrupamento e hierarquização dos solos. A dissolução dos óxidos de Fe é muito importante porque governa não somente a disponibilidade do Fe para plantas, mas também a liberação de ânions e cátions (metais pesados) associados às suas superfícies, e que podem ter um impacto na qualidade ambiental do solo. Os óxidos de Fe encontrados em maior proporção nos solos em estudo foram extraídos na fração F5, correspondente aos óxidos de Fe bem cristalizados, como goetita e hematita.
PALAVRAS CHAVES: fracionamento químico, solos, óxidos
INTRODUÇÃO: Os óxidos de Fe mais encontrados nos solos brasileiros são hematita, goetita, maghemita, magnetita e ilmenita e, em condições de intensa lixiviação, típicas das regiões tropicais e subtropicais, alguns desses óxidos podem dominar no solo, conforme a litologia do material de origem e os mecanismos de pedogênese (FERREIRA et al., 2007). A formação dos óxidos de Fe é influenciada pela dinâmica da água nos solos. Em solos periodicamente inundados como os solos do Pantanal, as superfícies dos minerais do solo são geralmente recobertas com camadas de óxido de Fe mal cristalizado e outros óxidos; sob inundação, esses recobrimentos podem ser removidos por dissolução redutiva, mas a maioria do ferro é depois reprecipitado como hidróxidos e carbonatos amorfos, resultando em mudanças químicas e morfológicas nos solos (KIRK et al, 2003). O estudo dos solos tropicais com ênfase nos óxidos de Fe se justifica pelo fato deles ocorrerem em proporções significativas e por exercerem papel relevante: (a) na relação solo-planta; (b) como indicadores dos processos de pedogenêse; (c) como critérios de agrupamento e hierarquização de solos e (d) como adsorvedores de poluentes do ambiente (EMBRAPA, 2006). Os óxidos de Fe e de Mn podem reter quantidades substanciais de metais pesados e influenciar na sua mobilidade no ambiente (SILVEIRA et al., 2006). A dissolução dos óxidos de Fe é muito importante porque governa não somente a disponibilidade do Fe para plantas, mas também a liberação de ânions e cátions (metais pesados) associados às suas superfícies, e que podem ter um impacto na qualidade ambiental do solo. Por isso, o objetivo deste estudo é empregar técnicas fracionamento químico dos óxidos de Fe em solos a fim de identificar o tipo predominante das formas de Fe no horizonte B dos solos.
MATERIAL E MÉTODOS: Foram selecionados quatro solos representativos do Pantanal do Mato Grosso, de onde foram retiradas amostras dos horizontes B2. As amostras foram destorroadas e secas ao ar, passadas em peneira de malha 2mm, antes de serem submetidas à caracterização química e física, de acordo com EMBRAPA (1997) e CAMARGO et al. (1986). Os óxidos de Fe e Mn foram extraídos utilizando-se a técnica de fracionamento químico (TESSIER et al., 1979; HUERTA-DIAZ E MORSE, 1990; FORTIN ET AL., 1993), cujos extratores foram: (a) MgCl2 0,1 mol.L-1 pH 7,0 – extrai o Fe trocável (F2) CH3COONa 1 mol.L-1 em ácido acético pH 5,0 – extrai o Fe ligado a carbonatos; (F3) cloridrato de hidroxilamina 0,04 mol.L-1 em ácido acético 25% (v/v) a T = 25ºC – extrai o Fe ligado à ferrihidrita; (F4) cloridrato de hidroxilamina 0,04 mol.L-1 em ácido acético 25% (v/v) a T = 96ºC – extrai o Fe ligado à lepidocrocita; (F5) tampão citrato de sódio 0,25 mol.L-1 + bicarbonato de sódio 0,11 mol.L-1 e ditionito de sódio à T = 75ºC – extrai o Fe ligado à goetita e hematita; (F6) HNO3 concentrado – extrai o Fe ligado à pirita; (HF): HF – extrai o Fe ligado aos silicatos e à matéria orgânica. Após as extrações, a determinação da concentração de Fe nos extratos foi feita por Espectrofotometria de Absorção Atômica com chama, após diluição adequada, e os resultados convertidos em teor de óxidos de ferro. O teor de Fe total nos solos foi determinado por Espectrometria de Fluorescência de Raios X e seus resultados também foram convertidos em Fe2O3.
RESULTADOS E DISCUSSÃO: O Fe trocável e ligado a carbonatos (F1 e F2) não foram expressivos nos solos. Os óxidos de Fe encontrados em maior proporção foram extraídos na fração F5, correspondente aos óxidos de Fe bem cristalizados, como goetita e hematita. Estes óxidos são, geralmente, fases residuais de decomposição de silicatos e por isso, abundantes em solos tropicais intemperizados (SCHWERTMANN e TAYLOR, 1989). Dos óxidos de Fe de baixa cristalinidade, a lepidocrocita (F4) obteve maior valor que a ferrihidrita (F3), em todos os solos. A lepidocrocita possui coloração alaranjada, particularmente nos mosqueados de solos gleizados, como os Gleissolos e Vertissolos. Já a ferrihidrita geralmente possui grau de cristalinidade baixo e elevada área superficial específica e, com o passar do tempo, pode se recristalizar à goetita, mais estável em ambientes tropicais (HOUBEN, 2003). A cristalinidade dos óxidos de ferro é variada, e corresponde ao grau de ordem estrutural das partículas minerais. Este parâmetro obedece à ordem: Fe(OH)3 amorfos < maghemita < lepidocrocita < hematita < goetita, o que está de acordo com a ordem de diminuição de solubilidade dos óxidos de ferro (SCHWERTMANN, 1985). Essa característica pode explicar fenômenos como a adsorção/liberação de íons no solo (metais e ânions). Observou-se que a fração F6 pode expressar o Fe associado com a matéria orgânica do solo na forma de complexos organominerais, visto que nos solos do Pantanal dificilmente se encontra Fe na forma de sulfetos (pirita), até porque todos os solos amostrados situavam-se em áreas bem drenadas durante a coleta, sendo mais comum a presença de pirita em solos de mangue. O Plintossolo apresentou maior teor de óxidos de Fe (nas frações e total) que os outros solos.
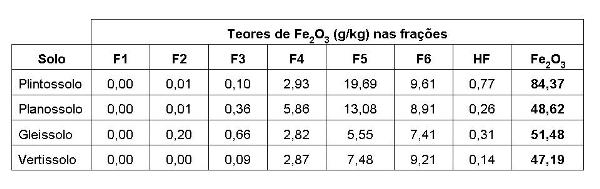
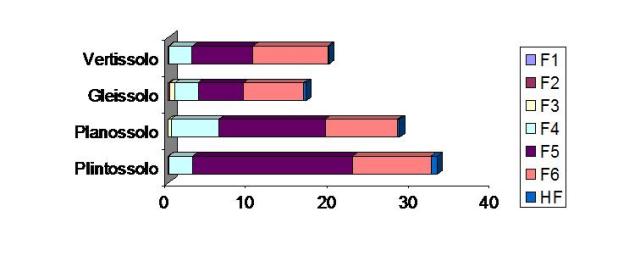
CONCLUSÕES: A dissolução dos óxidos de Fe é muito importante porque governa não somente a disponibilidade do Fe para plantas, mas também a liberação de ânions e cátions (metais pesados) associados às suas superfícies, e que podem ter um impacto na qualidade ambiental do solo. Os óxidos de Fe encontrados em maior proporção nos solos em estudo foram extraídos na fração F5, correspondente aos óxidos de Fe bem cristalizados, como goetita e hematita. Dos óxidos de Fe de baixa cristalinidade, a lepidocrocita (F4) obteve maior valor que a ferrihidrita (F3), em todos os solos. O Plintossolo apresentou maior teor de óxidos de Fe (nas frações e total) que os outros solos.
AGRADECIMENTOS: Ao prof. Xosé L. Otero, do Dep. Edafología e Química Agrícola-Faculdade de Biología-Universidade Santiago de Compostela - Espanha, pela realização das análises.
REFERÊNCIAS BIBLIOGRÁFICA: EMBRAPA. 2006. Sistema brasileiro de classificação de solos. Rio de Janeiro: Embrapa Solos. 306 p.
EMBRAPA. 1997. Manual de métodos de análise de solo. 2ª. ed. Rio de Janeiro: Embrapa/CNPS, 212p.
CAMARGO, O.A.; MONIZ, A.C.; JORGE, J.A. & VALADARES, J.M.A.S. 1986. Métodos de análise química, mineralógica e física de solos do Instituto Agronômico de Campinas – Boletim técnico106. Campinas: IAC, 94p.
FERREIRA, A.; VIDAL-TORRADO, P.; OTERO, X.L.; MACÍAS. F. 2007. Are mangrove forest substrates sediments or soils? A case study in southeastern Brazil. Catena n. 70, p.79–91.
FORTIN, D., LEPPARD, G.G., TESSIER, A., 1993. Characteristic of lacustrine diagenetic iron oxyhydroxides. Geochim. Cosmochim. Acta vol. 57, p. 4391–4404.
HUERTA-DÍAZ, M.A., MORSE, J.W., 1990. A quantitative method for determination of trace metal concentrations in sedimentary pyrite. Mar. Chem. Vol. 29, p. 119–144.
HUERTA-DÍAZ, M.A., MORSE, J.W., 1992. Pyritization of trace metals in anoxic marine sediments. Geochim. Cosmochim. Acta vol. 56, p. 2681–2702.
HOUBEN, G.J. 2003. Iron oxide incrustations in wells. Part 1: genesis, mineralogy and geochemistry. Applied Geochemistry v.18, p.927–939.
KIRK, G.J.D.; SOLIVAS, A.B.J.L.; ALBERTO, M.C. . 2003.Effects of flooding and redox conditions on solute diffusion in soil. European J. Soil Sci., v. 54, p. 617–624.
SCHWERTMANN, U. ; TAYLOR, R. M. 1989.Iron Oxides. In: DIXON, J. B.; WEED, S.B., (Eds.) Minerals in Soil Environments. 2.ed. Madison: Soil Science Society of America, p.379-438.
SCHWERTMANN, U. 1985. Some properties of soil and syntetic iron oxides. In: Iron in soils and clays minerals, Bad Windsheim, Germany, p. 567-638.
SILVEIRA ,M.L.; ALLEONI. L.R.F.; O’CONNOR. G.A.; CHANG, A.C. 2006. Heavy metal sequential extraction methods—A modification for tropical soils. Chemosphere. v. 64, p. 1929–1938.
TESSIER, A., CAMPBELL, P.G.C., BISSON, M., 1979. Sequential extraction procedure for the speciation of particulate trace metals. Anal. Chem. Vol. 51, p. 844–855.
