ÁREA: Química Tecnológica
TÍTULO: PRECIPITAÇÃO DE CARBONATO DE CALCIO A PARTIR DE ROCHA CALCARIA
AUTORES: BARBOSA,H.R.; GOETZ,C.M. (UNUCET-UEG)
RESUMO: A mineração é um setor em franca expansão no Brasil e no estado de Goiás. Esse setor fornece grande parte das matérias primas a serem utilizadas em outras atividades econômicas. O objetivo desse trabalho foi a precipitação do carbonato de cálcio proveniente da mineração da rocha calcaria. Primeiramente foram realizados testes para estabelecer condições e parâmetros a serem estudados. Em seguida fez-se um planejamento fatorial utilizando aqueles que mais se destacaram como variáveis. Os ensaios das precipitações foram analisados quanto a eficiência, de acordo com a alvura e através de testes de termogravimetria. O melhor resultado encontrado forneceu uma eficiência de 78,79%, tendo como condições iniciais temperatura de 50°C; relação [Ca]/[CO3]inicial 20/1 e tempo de reação 40 minutos.
PALAVRAS CHAVES: rocha calcaria, carbonato de calcio, precipitação
INTRODUÇÃO: A mineração é um setor em grande desenvolvimento no Brasil. No estado de Goiás ela expandiu muito e o estado já é o terceiro maior produtor mineral do país. (JBN,2009)
Uma atividade de mineração que vem sendo bastante praticada no estado de Goiás é a mineração de rocha calcaria que é constituída basicamente por carbonato de cálcio. Esse quando submetido a um processo de precipitação química fornece uma matéria prima bastante requisitada no setor industrial, o carbonato de cálcio precipitado. Essa precipitação além de eliminar as impurezas da rocha, permite obter cristais de forma e tamanho desejados. Essas alterações interferem em propriedades físicas dos cristais, tais como densidade do pó e área superficial, que possibilitam seu uso em formulações de sabonetes e creme dental. Com isso a tonelada desse produto é três vezes mais valorizada que o calcário natural. No Brasil algumas indústrias já efetuam esse procedimento, mas nenhuma em Goiás.
O objetivo deste trabalho foi primeiramente analisar as variáveis relevantes para precipitar o carbonato de cálcio a partir da rocha calcaria e otimizar o processo.
A precipitação do carbonato de cálcio pode ser influenciada por vários fatores que afetam diretamente a qualidade final do produto, tais como: relação entre o cálcio e o carbonato iniciais, teor de complexante, pH do meio, temperatura da solução, vazão e concentração de CO2 e Ca(OH)2. (OLIVEIRA,2005 e SOUTO,2008).
Encontramos descritos na literatura diferentes processos para essa precipitação (SOBRAL,1995; MARTHUR,2001; SOUTO,2008). O método mais utilizado é a carbonatação que consiste em calcinação do calcário, posterior hidratação do óxido de cálcio formando a polpa de hidróxido de cálcio e reação deste com o dióxido de carbono para precipitar o carbonato de cálcio.
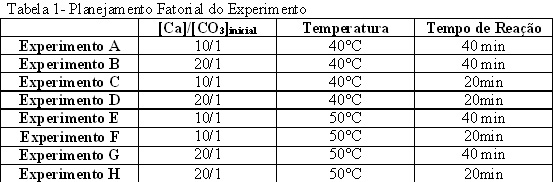
MATERIAL E MÉTODOS: A matéria prima utilizada foi cedida pela Goiasfiller Mineração Ltda situada na zona rural de Indiara-Go. As pedras naturais classificadas e separadas são levadas para os britadores onde seu tamanho é reduzido para então seguirem para os moinhos. O produto utilizado para a precipitação é micropluma calcítico ou malha 3000, por ser o produto mais fino e possuir maior superfície de contato. O reator foi montado utilizando um béquer com capacidade para 10L, chapa aquecedora, cilindro do CO2, medidores de vazão e pressão, termômetros e agitadores. Os fatores utilizados para controle do reator foram: tempo de reação, relação de concentração inicial entre cálcio e carbonato e temperatura da solução, mantendo constantes volume de água deionizada, massa do carbonato de cálcio natural, volume da solução de EDTA, pressão e vazão de CO2. O planejamento do experimento foi do tipo fatorial 23 conforme Neto et al (2001) e Rodrigues & Iemma(2005). Para a precipitação no primeiro momento a mostra foi calcinada em forno tipo mufla a 950°C por 4 horas. O óxido de cálcio obtido é passado em peneira com abertura de 50 Mesh e hidratado com água deionizada. À polpa formada é adicionado ácido sulfúrico e o produto levado ao reator onde se estabelece a injeção de CO2 e é introduzido o EDTA. Depois da reação completa o produto é decantado, filtrado e seco em estufa a 100°C. As análises do produto obtido foram a alvura em comparação com uma amostra padrão de cor, e a termogravimetria em equipamento DTG-60H da marca SHIMADZU. A amostra foi colocada em cadinho de alumina e foi submetida as seguintes condições de aumento de temperatura: 50° graus por minuto até 250º, 10°C por minuto até 350°C, 50°C por minuto até 750°C e 10°C por minuto até 900°C. O tempo total de análise foi de 40 minutos.
RESULTADOS E DISCUSSÃO: O princípio deste processo é a reação entre o óxido de cálcio e o dióxido de carbono, com adição de substâncias químicas para que a reação seja efetivada de forma rápida e resulte em um produto de melhor qualidade.
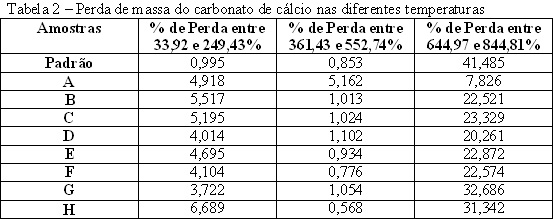
O planejamento fatorial do experimento é colocado na tabela 1 e as perdas de massa do carbonato de cálcio, em análise termogravimétrica proveniente dos oito experimentos planejados, se encontram na tabela 2. A análise termogravimétrica foi realizada para quantificar a perda de massa em relação a temperatura e dessa forma comprovar se houve de fato a formação do carbonato de cálcio e em que proporção ela ocorreu. Como prova analisou-se uma amostra padrão encontrada no mercado com qualidade comprovada. Como a massa molar do carbonato de cálcio é 100g, do óxido de cálcio 56g e o dióxido de carbono 44g, é de se esperar que se a perda em massa na sua temperatura de decomposição (temperatura de eliminação do CO2) seja 44%. Sabe-se que na prática é quase impossível obter valores iguais ao teórico. A amostra padrão teve perda de 41,485% na faixa de 644,97 a 844,81ºC, que é a faixa de eliminação do CO2, resultando uma eficiência de 94,28%. Tomando a amostra padrão como ideal no caso real e a partir dela analisando a eficiência da precipitação dos experimentos realizados encontramos o melhor resultado no experimento G, com eficiência de 78,79%. De acordo com o resultado obtido, percebe-se que a combinação de variáveis influi na eficiência. Para o reator em questão o melhor resultado(G) foi aquele que combinou maior relação carbonato de cálcio natural e óxido de cálcio (20/1), maior temperatura (50°C) e maior tempo de reação(40 minutos).
Para a alvura todos os resultados foram satisfatórios, já que houve a formação do produto em todos, o que variou foi a eficiência.
CONCLUSÕES: O melhor resultado obtido teve eficiência de 78,79% tendo como condições iniciais de experimento a temperatura de 50°C, relação [Ca]/[CO3]inicial 20/1 e tempo de reação 40 minutos. Já o pior resultado apresentou eficiência de 18,76% com as condições temperatura 40°C, relação[Ca]/[CO3]inicial 10/1 e tempo de reação 40 minutos. Portanto percebe-se que nenhuma das condições isoladas tem destaque, pelo contrário, o conjunto de maiores parâmetros se mostrou eficiente no processo e deve ser escolhido para a precipitação proposta.
AGRADECIMENTOS: A indústria de mineração Goiásfiller por ter dado todas as condições para realização do trabalho e a Central Analítica do IQ/UFG pelas análises termogravimétric
REFERÊNCIAS BIBLIOGRÁFICA: JBN – JusBrasil Notícias. Mineração é destaque no PIB goiano. Disponível em : <http:// www.jusbrasil.com.br/noticias/428415.html>
MARTHUR,V.K; 2001;High speed manufacturing process for precipitaded calcium carbonate employing sequential pressure carbonation. US Patente, n 6251356.Disponível em < http:// www.freepatentsonline.com/6251356.html>
NETO, B.B et al . Como fazer experimentos: pesquisa e desenvolvimento na ciência e na industria. Campinas:Editora da Unicamp,2001
OLIVEIRA, F.V. Processamento de carbonato de cálcio para a aplicação em industrias de de papel e plástico. Dissertação de mestrado, Escola de Engenharia/UFMG, Belo Horizonte, Brasil, 2005.
RODRIGUES, M.I.; IEMMA, A,F. Planejamento de experimentos e otimização de processos 1ª Ed. Campinas Casa do Pão,2005.
SOBRAL, F.E., Procedimento alternativo de preparação de carbonato de cálcio precipitado de elevada pureza. Dissertação de Mestrado. Departamento de Química Orgânica e Inorgânica, UFC, Fortaleza-CE; 1995.
SOUTO, E.C.S., Estudo de condições operacionais para a obtenção de carbonato de cálcio precipitado. Dissertação de Mestrado, Faculdade de Engenharia Química/UFU, Uberlândia-MG; 2008.
