ÁREA: Química Orgânica
TÍTULO: SÍNTESE, ELUCIDAÇÃO ESTRUTURAL E AVALIAÇÃO BIOLÓGICA DE NOVOS DERIVADOS CICLOALQUIL-TIOFÊNICOS
AUTORES: OLIVEIRA, T. B. (UFPE) ; LIMA, M. C. A. (UFPE) ; BOTELHO, S. P. S. (UFPE) ; SILVA, W. L. (UFPE) ; AQUINO, T. M. (UFPE) ; MENDONÇA JUNIOR, F. J. B. (UEPB) ; GALDINO, S. L. (UFPE) ; PITTA, I. R. (UFPE)
RESUMO: Esse trabalho teve como foco a obtenção de novos derivados tiofênicos como candidatos a
novos antifúngicos. Os compostos tiveram suas estruturas devidamente comprovadas por
RMN 1H e outras técnicas espectroscópicas. Para avaliação do potencial antifúngico dos
derivados de tiofeno, 3 compostos foram avaliados in vitro, em um teste de
sensibilidade, frente a 5 isolados clínicos de Candida e 2 de Cryptococcus neoformans,
comparadas ao fluconazol e anfotericina B, apresentando valores de CFM de 800 a 3.200
µg/mL. O composto (LPSF/SB-36) foi o mais ativo da série, com valores de CFM (100-800
µg/mL). Todos os compostos foram sintetizados com um alto rendimento, comprovando a
validade das rotas sintéticas empregadas.
PALAVRAS CHAVES: derivados tiofênicos, candida e antifúngicos.
INTRODUÇÃO: A resistência microbiana é uma problemática de relevância mundial, que afeta milhares
de pessoas anualmente e que se tornou a partir das duas grandes guerras alvo
interessante para variados grupos de pesquisa ao redor do mundo. Contudo, graças à
crescente busca por novos antimicrobianos, cientistas buscaram a síntese de derivados
tiofênicos que possuem esta atividade (CHABERT et al., 2007). Diante disso, relatamos
a síntese de novos derivados de tiofeno. Os compostos finais sintetizados (LPSF/SB-
36, LPSF/SB-39, e LPSF/SB-40) apresentam além do anel tiofênico uma cadeia alquil-
cíclica lateral, visto que isso proporciona um aumento da atividade antimicrobiana. A
avaliação de suas atividades antifúngicas foram determinadas por meio das
concentrações fungicidas mínimas (CFM) através do método de microdiluição em caldo,
frente a quatro espécies de Candida (42 isolados) e duas amostras de Cryptococcus
neoformans.
MATERIAL E MÉTODOS: Os reagentes utilizados para a síntese dos derivados tiofênicos foram: acetato de
etila; cianoacetato de etila; etanol; n-hexano; benzaldeídos substituídos; enxofre,
malonitrila, morfolina; ciclopentanona, ciclohexanona, cicloheptanona, etanol
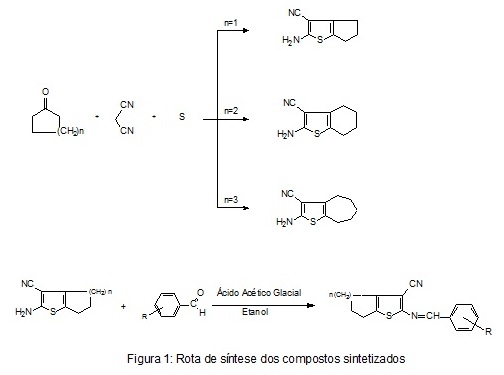
absoluto e ácido acético glacial. O diagrama de síntese para obtenção dos derivados
tiofênicos finais consta de duas etapas. A primeira etapa consta da formação do anel
tiofênico por meio da síntese de Gewald e a segunda etapa é caracterizada por ser uma
reação de condensação entre o produto da primeira etapa e do aldeído de escolha. A
caracterização estrutural foi realizada por meio dos espectros de ressonância
magnética nuclear de hidrogênio (RMN1H), de carbono (RMN 13C) e de Infravermelho
(IV). A atividade antifúngica in vitro dos compostos sintetizados LPSF/SB foi
investigada contra um total de 44 cepas fúngicas, incluindo quatro espécies de
Candida (C. albicans; C. krusei; C. parapsilosis e C. tropicalis e Cryptococcus
neoformans). Candida parapsilosis (ATCC 22019) foi utilizado como cepa controle. Os
valores das concentrações fungicidas mínimas (CFMs) de cada um dos derivados
tiofênicos testados SB-36, SB-39 e SB-40 foram determinados através do método de
microdiluição em caldo seguindo as condições descritas no protocolo M27-A2 do
Clinical and Laboratory Standard Institute (CLSI), utilizando concentrações
decrescente de cada uma das drogas isoladamente (3.200 – 6,25 µg/mL). Esses valores
foram comparados com os valores obtidos com os mesmos ensaios realizados com as
drogas referência fluconazol e anfotericina B.
RESULTADOS E DISCUSSÃO: Os compostos testados LPSF/SB apresentaram bons rendimentos sem a necessidade de
purificação por cromatografia em coluna, sendo apenas necessárias etapas de lavagens
e recristalização, indicando a efetividade da rota sintética (Figura 1). Acerca do
mecanismo reacional, na primeira etapa da rota ocorre a obtenção do composto
intermediário que pode possuir um ciclo de 5, 6 ou de 7 membros e se procede por
meio da reação de Gewald. Na segunda etapa da rota de síntese o produto final é
obtido por meio da condensação de knoevenagel e a reação se procede entre o composto
intermediário LPSF/SB obtido na primeira etapa e entre um aldeído de escolha. Na
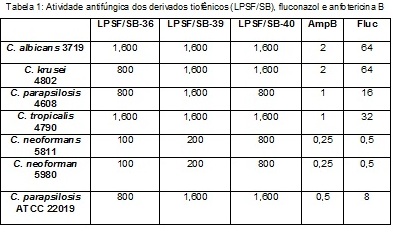
atividade biológica, o derivado ciclohexila substituído com o grupamento 4-NO2 (SB-
36) exibiu o melhor perfil de atividade antifúngica, e os menores valores de CFM, que
foram de 2 a 8 vezes menores que os referentes aos derivados ciclohexila (SB-39 e SB-
40). Este composto apresentou também valores de CFM entre 100-200 µg/mL em vários
casos, enquanto que a anfotericina B e fluconazol tiveram valores de 0,25 µg/mL e 16
µg/mL (Tabela 1). De acordo com a avaliação das relações de estrutura química x
atividade biológica (SAR), o tamanho do anel cicloalquila acoplado às posições 4 e 5
do anel tiofênico exerceram importante influência na atividade antifúngica, uma vez
que foi observado diferenças significativas das atividades em cada uma das séries
testadas.
CONCLUSÕES: Todos os compostos foram obtidos com bons rendimentos. Com isso comprova-se a validade
das rotas sintéticas utilizadas. Os derivados tiofênicos (LPSF/SB) se mostraram
eficientes em inibir o crescimento fúngico in vitro para as cepas dos microorganismos
testados. Os valores de CFM foram fracos a moderados (800-3.200 µg/mL), especialmente
ao que se referem às cepas de Cryptococcus que se mostraram significativamente mais
sensíveis (100-800 µg/mL). Entretanto, o fato que torna a continuidade dessa pesquisa
mais animador é a desejável característica antifúngica dessa classe de compostos.
AGRADECIMENTOS: Á todos os órgãos de fomento: Cnpq, Capes e Facepe.
À Universidade Federal de Pernambuco.
REFERÊNCIAS BIBLIOGRÁFICA: CHABERT, J.F.; MARQUEZ, B.; NEVILLE, L.; JOUDA, L.; BROUSSOUS, S.; BOUHOURS, P.; DAVID, E.; PELLET-ROSTAING, S.; MARQUET, B.; MOREAN, N.; LEMAIRE, M. 2007. Synthesis and evaluation of new arylbenzo[b]thiophene and diarylthiophene derivates as inhibitors of the NorA multidrug transporter of Staphylococcus aureus. Bioorganic & Medicinal Chemistry, 15: 4482-4497.
