ÁREA: Alimentos
TÍTULO: Cararcterização fisico-quimica do mel de Apis mellifera L. produzido na cidade de Ipu.
AUTORES: ANDRADE,SAMARA RÉGIA DE (UECE) ; LIBERATO, M. C. T. C. (UECE)
RESUMO: O mel é um produto líquido ou semi-líquido produzido por abelhas melíferas a partir do néctar das flores e tem sido usado desde a antiguidade. Ele apresenta cerca de 200 substâncias e é parte importante da medicina tradicional. O objetivo desse trabalho foi analisar o mel de Apis mellifera L. produzido na cidade de Ipu. Foram utilizadas as seguintes metodologias: Determinação do teor em fenóis totais, pelo método de Folin-Ciocalteau, Determinação da atividade antioxidante pelo método do DPPH e da atividade antiacetilcolinesterase utilizando-se o método Ellman modificado por Rhee.
PALAVRAS CHAVES: atividade antioxidante,antiacetilcolinesterase,fenois totais
INTRODUÇÃO: O mel é uma substância produzida pelas abelhas e outros insetos sociais a partir do néctar das flores ou de outras secreções de plantas que elas coletam e transforma através da evaporação da água e da adição de enzimas. As abelhas são insetos que pertencem á ordem Himenóptera, tendo surgido na face da terra há mais de cinqüenta milhões de anos e sempre presente em civilizações antigas como dos gregos e egípcios. Existem abelhas solitárias, semi-sociais e sociais, sendo a comunicação o principal fator que as distingue quanto a sua sociabilidade (IOIRISH,1981). É considerado um dos alimentos mais puros da natureza e apresenta riqueza de elementos em sua composição. Bastante água, glicose, frutose, sacarose e maltose, sais minerais, vitaminas, enzimas, hormônios, proteínas, ácidos, aminoácidos e fermento. (BATISTA, 2004). A criação racional de abelhas constitui uma atividade em que se consegue obter bons resultados econômicos, ecológicos e sociais. Essa atividade, desenvolvida ao longo do tempo por pequenos, médios e grandes produtores, vem despertando o interesse de muitos criadores e instituições do Brasil. (RODRIGUES, 2011).
Sistematicamente, apicultores e consumidores, de todo País, têm demonstrado grande preocupação com a qualidade dos méis. Visando obter informações sobre o mel comercializado e consumido pela população da cidade de Ipu no Ceará, foi desenvolvido esse trabalho.
MATERIAL E MÉTODOS: As amostras foram coletadas com apicultores da cidade de Ipu. Determinação de Fenóis
Totais: Foi usado o método Folin-Ciocalteau (SINGLETON; 1999). 5g de mel foram
diluídos em 50mL de água destilada. 0,5mL dessa solução foi misturada com 2,5mL do
reagente por 5min, e 2mL de carbonato de sódio (75g/L). Após 2 h, a absorbância foi
medida a 760 nm contra um branco. O ácido gálico foi usado como padrão. O Teor de
fenóis foi expresso em mg (EAG)/100g de mel. Determinação de Flavonóides: 5 mL de
cloreto de alumínio (2%), em metanol, foi adicionada ao mesmo volume de uma solução
de mel (0,02 mg/mL). A absorbância foi lida em 415 nm, após 10min contra um branco. A
curva da quercetina foi usada como padrão. O conteúdo de flavonóides foi expresso em
mg (QE)/100g de mel. Avaliação da Atividade Antioxidante: foi usado o método do DPPH
(BRAND WILLIAMS 1995). 1,25mL de uma solução de mel foram misturados com 1,5mL de uma
solução de DPPH em metanol (90mg/L). Após 15min a absorbância foi lida a 517 nm
contra um branco de metanol. Determinação da atividade antiacetilcolinesterase:
Foram usadas soluções de ácido 5,5’-ditiobis-2-nitrobenzóico (DTNB) e iodeto de
acetilcolina (ATCI) em tampão. As amostras foram aplicadas na cromatoplaca. Após
evaporação do solvente, pulverizou-se o substrato (ATCI, 1mM em tampão) e o reagente
de Ellman (DTNB, 1 mM em tampão). Após 3 a 5 min borrifou-se a enzima (3U/mL) e em 10
min a placa desenvolveu cor amarela. Halos brancos apareceram em torno das amostras
indicando inibição, foram medidos e comparados com o padrão Fisostigmina que
apresenta halo de inibição de 0,9 mm (RHEE et al, 2001).
RESULTADOS E DISCUSSÃO: Os resultados obtidos são apresentados na tabela 1, os valores foram obtidos em triplicata. A metodologia utilizada para a determinação da atividade antioxidante nos permitiu determinar um CI50 (concentração que causa 50% de inibição). Pelos valores obtidos verifica-se que os resultados são similares aos apresentados por MEDA et al. (2005) ao analisar amostras de Burkina Faso. A atividade antioxidante obtida através do ensaio feito com o radical livre estável DPPH mostrou que o mel obteve um excelente resultado podendo ser utilizado como alimento funcional por seu teor de fenóis e atividade antioxidante. Tabela 1 - Teor de Fenóis Totais, Flavonóides, Atividade Antioxidante e Atividade Antiacetilcolinesterase
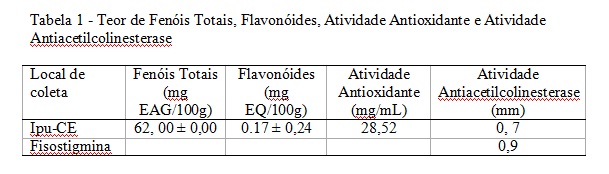
CONCLUSÕES: Os teores de fenóis totais, a atividade antioxidante e a atividade antiacetilcolinesterase são relevantes o que poderia fundamentar seu uso como fitoterápico e/ou alimento funcional.
AGRADECIMENTOS: A Deus e minha Orientadora
REFERÊNCIAS BIBLIOGRÁFICA: BATISTA, Cristiane. A Natureza é o meio.Almanaque Rural Apicultuta nº 01. São Paulo:Escala, 2004. p 64, 65
BRAND-WILLIAMS, W., CUVELIER, M. E. e BERST, C. 1995. Use of a free radical method to evaluate antioxidant activity. Lebensmittel Wissenschaft Und Technologie, 28: 25-30.
IOIRICH, N. As abelhas, farmacêuticas com asas. São Paulo: Moscovo, URSS 1981.
MEDA, A., LAMIEN, C. E., ROMITO, M., MILLOGO, J., NACOULMA, O. G. 2005. Determination of the Total Phenolic, Flavonoid and Proline Contents in Burkina Fasan Honey, as well as their Radical Scavenging activity. Food Chemistry, 91: 571-577.
RHEE, I. K., MEENT, M., INGKANINAN, K., VERPOORTE, R. 2001. Screening for acetylcholinesterase inhibitors from Amaryllidaceae using silica gel thin-layer chromatography in combination with bioactivity staining. Journal of Chromatography A, 915: 217-223.
RODRIGUES, A.E.; da SILVA, E.M.S; BESERRA, E.M.F.; RODRIGUES, M.L. Análise
físico-química de méis das abelhas Apis Mellifera e Melipona Scutellaris. Agronline.com.br Disponível em:<http://www.agronline.com.br/agrociencia/artigo/
50>. Acesso em: 16 de janeiro de 2011.
SINGLETON, V. L., ORTHOFER, R., LAMUELA-RAVENTOS, R. M. 2002. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods in Enzymology, 299: 152-178
