ÁREA: Físico-Química
TÍTULO: Estudo teórico ab initio/DFT da reação de esterificação da glicerina com ácido acético
AUTORES: MOREIRA-SANTOS, R.D. (UFMT) ; HUPPES DA SILVA, A.C. (UFMT) ; DA SILVA, S.C. (UFMT)
RESUMO: A reação de esterificação de glicerina via ataque com acido acético foi estudada teoricamente por cálculos ab initio/DFT, com utilização do método hibrido B3LYP com conjunto de bases 6-31+G(d,p). Tanto por ataque via hidroxila lateral ou central da glicerina, a modelagem da reação leva à formação de um complexo intermediário tetraédrico. Em ambas as reações a etapa determinante da reação foi a primeira, nas quais foram encontradas energias de ativação Eaet1 = 45,60 kcal/mol e Eaet1 = 43,49 kcal/mol, respectivamente. Para a esterificação da hidroxila lateral, os cálculos forneceram ΔH = 11,75 kcal/mol, enquanto para esterificação da hidroxila central obteve-se ΔH = -2,10 kcal/mol.
PALAVRAS CHAVES: glicerina, ácido acético e cálculo dft.
INTRODUÇÃO: A produção de biodiesel vem ganhando importância mundial nos últimos anos como um combustível limpo e renovável. Como conseqüência desta crescente produção do biodiesel, tem havido um grande aumento na produção de glicerina, que ocorre na proporção de 90 m3 de combustível renovável para cerca 10 m3 de glicerina. Em virtude disso, estão surgindo vários estudos para utilização deste co-produto como principal base para a produção de derivados atrativos para o mercado consumidor. As reações de esterificações da glicerina com anidrido acético ou ácido acético produzem o monoacilglicerideo, diacilglicerideo e o triacilglicerideo os quais podem ser chamadas de monoacetina, diacetina e a triacetina. Estes derivados da glicerina possuem importância industrial. A monoacetina é utilizada como aditivos alimentares, preparação de antídotos, no fumo e fabricação de explosivos; a diacetina em conjunto com a monoacetina possui aplicação em criogenia, poliésteres biodegradáveis, produtos alimentícios e em indústria de cosméticos. A triacetina tem o papel muito importante em relação aos outros derivados da glicerina, pois ela é usada principalmente como aditivo de combustível. Além destes usos, a monoacetina, diacetina e triacetina também são utilizadas em conjunto como solventes para tintas de impressão e corantes e plastificantes. Como parte deste estudo da degradação da glicerina, neste trabalho procura-se determinar teoricamente a cinética da primeira reação de esterificação do ácido acético com a glicerina nas suas diferentes hidroxilas com o uso de cálculos quânticos computacionais baseados em métodos ab initio/DFT.
MATERIAL E MÉTODOS: As simulações computacionais das reações de degradação da glicerina foram efetuadas com o uso do programa de cálculos quânticos computacionais Gaussian03. Foi utilizado o método ab initio e Teoria do Funcional da Densidade (DFT) com a aproximação de Becke (Funcional hibrido - B3LYP) para correção energia de correlação e troca e o conjunto de funções de base 6-31+G(d,p). Inicialmente foram otimizadas as estruturas dos reagentes isoladamente. A seguir foi otimizada a estrutura dos reagentes juntos, o que leva o sistema a uma estrutura de “complexo reagente” com mínimo de energia. A seguir foi escolhida uma “coordenada de reação”, com a hidroxila da glicerina atacando a carbonila do ácido acético. Fazendo variar esta coordenada de reação, otimizando o restante da estrutura a cada ponto, gerou-se uma superfície de energia potencial (PES), que leva a formação de uma estrutura intermediaria. A partir desta estrutura intermediaria foi definida outra coordenada de reação e geração de outra PES, com a migração de um próton de uma das hidroxilas para a outra, ocasionando a saída da água e a formação da monoacetina. Através da PES, otimizaram-se as estruturas dos estados de transição (TSx), com o método QST3 disponível no programa Gaussian03. Otimizados estes, efetuaram-se os cálculos das coordenadas intrínsecas de reação (IRC), com os quais se determinou as energias de ativação (Eax), energias relativas do sistema (ΔEx) e as estruturas dos reagentes, dos intermediários e produtos.
RESULTADOS E DISCUSSÃO: Os resultados das simulações das reações sugerem que esta reação de esterificação possui duas etapas, sendo a primeira o reagente formando o intermediário tetraédrico e a segunda etapa do intermediário tetraédrico para o produto, como é demonstrado na literatura6. Através das figuras 1 e 2, os quais representam as coordenadas intrínsecas de reação, vê-se que a primeira etapa da reação de esterificação, onde a carbonila do ácido acético é “atacada” pela hidroxila da glicerina formando o intermediário, é a etapa determinante, devido a sua maior energia de ativação. Nos resultados mostrados nas figuras 1 e 2 atribuiu-se o valor zero às energias do complexo reagente. Em seguida, calculou-se a energias de ativação e a energias relativas do sistema em relação à energia do complexo reagente. Na figura 1 são mostrados os dados referentes à reação de esterificação via a hidroxila da extremidade. Nesta reação encontrou-se energias de ativação Eaet1 = 45,60 kcal/mol para a primeira etapa, Eaet1 = 38,19 kcal/mol para a segunda etapa e entalpia de reação ΔH = 11,75 kcal/mol. Para a reação de esterificação via hidroxila central da glicerina encontrou-se Eaet1 = 43,49 kcal/mol; Eaet2 = 34,73 kcal/mol e ΔH = -2,10 kcal/mol, como é mostrado na figura 2.
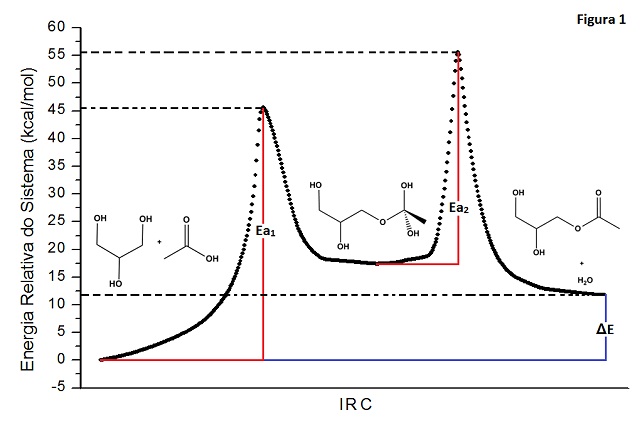
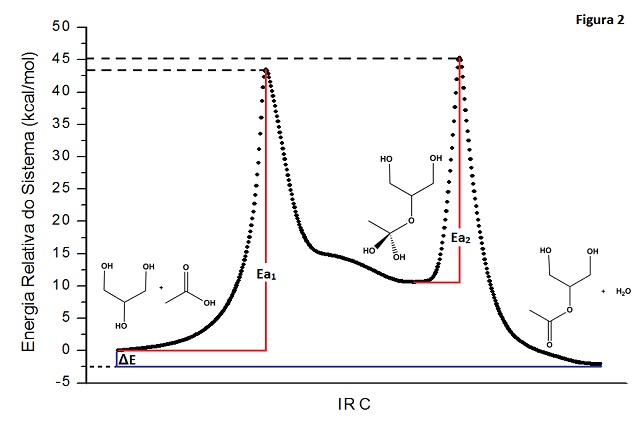
CONCLUSÕES: De acordo com os resultados dos cálculos quânticos computacionais, observou-se que a reação de esterificação não privilegia o “ataque” das hidroxilas das extremidades ou hidroxila central da glicerina, pois as suas energias de ativação são próximas. Devido ao valor da energia da ativação nas etapas determinantes, espera-se que estas reações sejam bastante lentas para processos a temperatura ambiente.
AGRADECIMENTOS: A. C. Huppes da Silva e R. D. Moreira-Santos agradecem CNPq, por suas bolsas de Mestrado e Iniciação Científica, respectivamente.
REFERÊNCIAS BIBLIOGRÁFICA: Gonçalves V.L.C., Pinto B.P., Silva J.C., Mota C.J.A. Acetylation of glycerol catalyzed by different solid acids. Catalysis Today 133-135, p. 673-677, 2008.
Xiaoyuan Liao, Yulei Zhu, Sheng-Guang Wang, Hongmei Chen, Yongwang Li. Theoretical elucidation of acetylating glycerol with acetic acid and acetic anhydride. Applied Catalysis B: Environmental 94, p. 64-70, 2010.
Solomons, T.W.G. Química Orgânica, volume 2; tradução Oliveira, M.L.G.; revisão técnica Raslan, D.S., Matos, R.M. – Rio de Janeiro: LTC, 2009.
Gaussian03, Revision B. 03 J. A. Pople et. Alli Gaussian, Inc., Pittsburgh PA, 2003.A
D. Becke, J. Chem. Phys. 98, 5648 (1993).
G. A. Peterson and M. A. Al-Laham, J. Chem. Phys. 94, 6081(1991).
G. A. Peterson, A. Bennett, T. G. Tensfeldt, M. A. Al-Laham, W. A. Shirley, and J. Mantzaris, J. Chem. Phys. 89, 2193(1988).
