ÁREA: Físico-Química
TÍTULO: Efeito da substituição de Hidrogênio por átomos de Flúor na Energia e na localização de alguns Orbitais no Oxigênio da N,N-dimetil-nitrosamina
AUTORES: ANDRADE, R. B. DE (UFPB) ; MONTE, S. A. (UFPB) ; VENTURA, E. M. (UFPB) ; SANTANA. S. R. DE (UFPB) ; FRAGOSO, W. D. (UFPB)
RESUMO: As Nitrosaminas são compostos derivados do grupo nitroso (-NO) com o grupo amino (-NH2), de fórmula estrutural R1R2NNO, com R1 e R2 sendo grupos alquila ou arila. As Nitrosaminas são metabolizadas pelo Citocromo P450, desencadeando um processo carcinogênico. A Nitrosamina pode coordenar com o centro de Ferro do grupo HEME. O objetivo desse trabalho será investigar como a substituição de Hidrogênio por átomos de Flúor pode modificar a interação da N-N-dimetil-Nitrosamina com o centro de Ferro do grupo HEME. Serão feitos cálculos de estrutura eletrônica DFT/B3LYP e MP2. Observou-se variação na localização dos orbitais que influenciam na interação, mas apenas o aumento da quantidade de substituintes não garante uma maior localização destes orbitais na ligação N=O da nitrosaminas.
PALAVRAS CHAVES: nitrosaminas, orbitais de fronteira, localização no oxigênio.
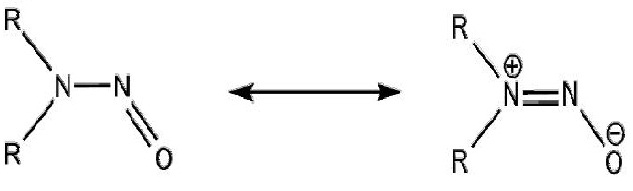
INTRODUÇÃO: As Nitrosaminas são compostos derivados do grupo nitroso (-NO) com o grupo amino (-NH2), de fórmula estrutural R1R2NNO, com R1 e R2 sendo grupos alquila ou arila. A contaminação pode ocorrer de forma direta pelas Nitrosaminas ou ainda por compostos com Nitrato (reagem com as aminas das proteínas), alguns Nitratos são usados como conservantes de carnes. As Nitrosaminas são metabolizadas pelo Citocromo P450, desencadeando um processo carcinogênico. A Nitrosamina pode coordenar com o centro de Ferro do grupo HEME. Estudos com a cristalização da Porfirina Ligante e caracterizaram da interação da nitrosamina com a Ferroporfirina do grupo HEME (ADDO et al, 1996), concluindo que para ocorrer a coordenação via Oxigênio, o grupo AMINO (R1R2N-) deve apresentar a estrutura de ressonância (ver Figura 1). Diante da comprovação da existência da interação via Oxigênio (ADDO et al, 2010), nossa motivação inicial é: Como a substituição dos Hidrogênios por átomos de Flúor modificam essa interação? A interação esta relacionada com a – Energia e Interação de alguns Orbitais (ver Figura 2) – das Nitrosaminas com os orbitais d do Ferro. Na investigação observando-se a Energia desses Orbitais em conjunto a localização dos mesmos no Oxigênio. Os orbitais de fronteira no Ferro do grupo HEME encontram-se no subnível d, já os orbitais estudados nas Nitrosaminas estão em um nível mais elevado (possuem mais Energia), para uma melhor interação será preciso diminuir essa diferença de Energia; o aumento da sobreposição dos orbitais da Nitrosamina com os orbitais d do Ferro será maior quanto maior for a localização dos orbitais estudados no Oxigênio, já que a interação ocorre via Oxigênio da Nitrosamina
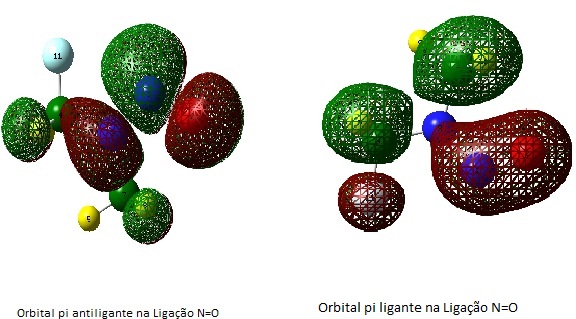
MATERIAL E MÉTODOS: Para a análise das possíveis estruturas aplicamos um planejamento fatorial (2 elevado a sexta), com as todas as possibilidades entendermos a influência dos substituintes (Hidrogênio ou Flúor). Foram realizados cálculos de otimização e frequência de 64 estruturas no Gaussian09 empregando os métodos Teoria do Funcional da Densidade DFT com o funcional B3LYP e Teoria de Perturbação de Møller-Plesset de segunda ordem MP2, em ambos com a base cc-pVTZ. Para obtermos os valores de Energias e as Localizações dos orbitais no Oxigênio, realizou-se cálculos de Single-point a nível Hartree-Fock nas estruturas já otimizadas. Existem orbital de fronteira HOMO (Orbital Molecular Ocupado de Mais Alta Energia) e LUMO (Orbital Molecular Desocupado de Mais Baixa Energia). Analisou-se nesse trabalho os orbitais π (ligante e antiligante) referentes a ligação N=O das N,N-dimetil-nitrosamina, pois estes determinam a intensidade da interação com o ferro do grupo HEME (localizam-se acima e abaixo do eixo internuclear).
RESULTADOS E DISCUSSÃO: Com os resultados dos cálculos investigamos as Localizações dos orbitais em estudo na ligação N=O. Obtivemos dos orbitais estudados para a Nitrosamina sem átomos de Flúor, já que a interação ocorre via oxigênio, os seguintes valores: pi Ligante entre a ligação N=O 0,124815 e para o pi antiligante na mesma ligação foi 0,275023 (esses valores foram para a Nitrosamina sem átomos de Flúor). Com relação aos orbitais pi ligantes referentes a ligação N=O observou-se uma variação entre os seguintes valores 0,029382 (Estrutura com 4 átomos de Flúor) e 0,139404 (Estrutura com 4 átomos de Flúor). Observamos para os orbitais pi antiligantes referentes a ligação N=O uma variação entre 0,321390 (Estrutura com 6 átomos de Flúor) e 0,267649 (Estrutura com apenas 1 átomo de Flúor). Observou-se uma combinação dos orbitais não-ligantes do Nitrogênio (Nitrogênio que esta ligado aos carbonos) com os orbitais pi antiligantes referentes a ligação N=O, evidenciando uma contribuição de um na formação do outro.
CONCLUSÕES: Com os resultados podemos concluir que apenas o aumento da quantidade de átomos de flúor existentes na N,N-dimetil-Nitrosamina não garante uma maior localização no Oxigênio dos orbitais estudados.
AGRADECIMENTOS: UFPB e ao CNPq
REFERÊNCIAS BIBLIOGRÁFICA: ADDO, G. B. R.; YI, G. B. ; KHAN, M. A. ; Chem. Commun. 1996, 2045-2046.
ADDO, G. B. R. ; XU, N. ; GOODRICH, L. E. ; LEHNERT, N. ; POWELL, D. R. Inorg. Chem. 2010, 49, 4405.
