ÁREA: Físico-Química
TÍTULO: Eletro-oxidação de glicerol em eletrodos de platina
AUTORES: ARAUJO, H. R. (UFMA) ; BOSCHETO, E. () ; JALDYR DE JESUS GOMES VARELA JUNIOR () ; GIUSEPPE A CAMARA () ; PABLO S FERNÁNDEZ () ; HAMILTON B VARELA () ; LIMA, R. B. (UFMA)
RESUMO: A eletro-oxidação de glicerol foi estudada em eletrodos de platina eletrodepositada. Os experimentos foram conduzidos em diferentes temperaturas em meio ácido. Técnicas de espectroscopia foram empregadas na determinação da natureza de espécies adsorvidas e de produtos de oxidação. Cronoamperometria e voltametria cíclica foram utilizadas para caracterização eletroquímica da superfície catalítica. É verificada a formação de ácido carboxílico, aldeído e dióxido de carbono durante a oxidação do glicerol. O aumento da temperatura contribui para que a oxidação do glicerol ocorra em potenciais mais baixos além de produzir um aumento na corrente. Eletrodos com maiores quantidades de platina tem melhor eficiência em temperaturas mais altas que a ambiente.
PALAVRAS CHAVES: glicerol, eletrocatálise, platina
INTRODUÇÃO: O glicerol é um poliol e o uso deste composto como combustível tem despertado o interesse de trabalhos em eletrocatálise (JEFFERY et al., 2010; SIMÕES et al., 2010) Ele apresenta a vantagem de ter baixa toxidade quando comparado com o metanol, baixa volatilidade quando comparado com o etanol e apresentar uma densidade energética relativamente alta. Em termos numéricos, o glicerol libera 14e- durante a sua na oxidação total. Este álcool é um subproduto obtido da purificação do biodiesel, além de poder ser produzido por fermentação microbiana (WANGA et al., 2001). Além disso, é uma molécula altamente funcional através da qual vários outros compostos podem ser sintetizados, alguns destes de importante valor comercial (GALLEZOT et al., 1997). Portanto, devido à grande quantidade de glicerol disponível, muito tem se pesquisado a respeito de outras aplicações práticas para ele.
O estudo da eletro-oxidação de substâncias orgânicas sobre a superfície de metais considerados nobres tem aumentado tendo em vista, a suas aplicações em fontes energéticas mais limpas e eficientes,as células a combustível. A platina tem demonstrado ser o principal e mais eficaz catalisador para a oxidação de muitos compostos orgânicos, principalmente em meio ácido (IWASITA et al., 1989). Contudo, além do elevado preço, a mesma apresenta um grande obstáculo a ser contornado que é a formação de espécies de difícil oxidação que bloqueiam a superfície do catalisador durante a eletrólise, como por exemplo o CO (MATSUOKA et al., 2005). Este estudo tem por objetivos avaliar os efeitos da temperatura durante a oxidação de glicerol em cada eletrodepósito de platina e determinar a natureza dos produtos de oxidação deste álcool, bem como avaliar o desempenho destes catalisadores com a variação de temperatura.
MATERIAL E MÉTODOS: A eletrodeposição de platina foi feita mediante a aplicação de um potencial constante (0,2 V) primeiramente por 10 s sobre a superfície de uma placa de ouro de 0,5 cm2 de área geométrica imersa em uma solução de ácido platínico (H2PtCl6) 2 mM em ácido perclórico (HClO4) 0,1 M. Do mesmo modo, este procedimento foi repetido para 30, 60, 120, 180 e 300 s. Varreduras potenciométricas (a 50 mV.s-1) de 0,05 V a 1,45 V na presença do glicerol foram realizadas na temperatura ambiente e então o potencial foi fixado em 0,6 V, para a obtenção dos dados potenciostáticos durante 15 minutos. As cronoamperometrias foram feitas em triplicata de maneira seqüencial. Isto em um potenciostato Princeton Applied Research Model 263A. Utilizando este mesmo procedimento, foram coletados dados potenciométricos e potenciostáticos nas temperaturas de 35 (± 1), 45 (± 1) e 55 ºC (± 1) e para todos os eletrodepósitos preparados.
As medidas de espectroscopia de infravermelho por reflexão externa (FTIRAS) foram feitas usando um disco de platina policristalina de 1 cm2 de diâmetro como eletrodo de trabalho. Após o tratamento da superfície do eletrodo de trabalho com chama (butano) e resfriá-lo em uma atmosfera inerte (N2), colocou-se o mesmo próximo à uma janela prismática, formando entre eles uma fina camada de solução. Os dados espectrais coletados se referem às reações que estão acontecendo entre o eletrodo de trabalho e a camada fina da solução. Foram utilizadas duas janelas, uma de CaF2 e outra de BaF2 nestas medições. A luz infravermelha é lançada a partir de uma fonte e desviada por um espelho até a interface eletrodo/solução. A radiação retorna incidindo sobre um segundo espelho e se dirige ao detector. Isto foi realizado em um espectrômetro Nicolet Nexus 670 equipado com um detector MCT.
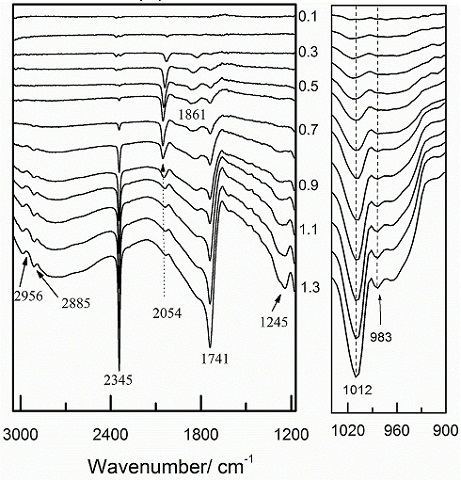
RESULTADOS E DISCUSSÃO: Dados de espectrosopia
Aplicando a técnica FTIRAS, foram vistas diferentes bandas. Segundo a literatura a banda em 2345cm-1 pertence ao CO2 formado a partir de CO adsorvido (JEFFERY et al., 2010); a banda em 2054cm-1 é referente ao COad de maneira linear, enquanto que a que surge em 1861cm-1 refere-se ao COad na forma de ponte (PASTOR et al., 2002); a banda em 1741cm-1 indica um composto que possui carbonila. A banda em 1245cm-1 pertence a um ácido carboxílico (IWASITA et al., 1997). A banda em 983cm-1 aparece apenas em 0,8V e neste mesmo potencial a banda em 1245cm-1 começa a crescer sugerindo que um ácido carboxílico seja responsável pelo aparecimento dessa banda. Em relação à banda em 1012cm-1 é observado que ela já surge em potenciais baixos e aumenta com o potencial. Isto significa que o composto que está sendo formado não precisa de espécies doadoras de oxigênio adsorvidas, resultando de uma desidrogenação. Assim pode se tratar de um aldeído ou uma cetona.
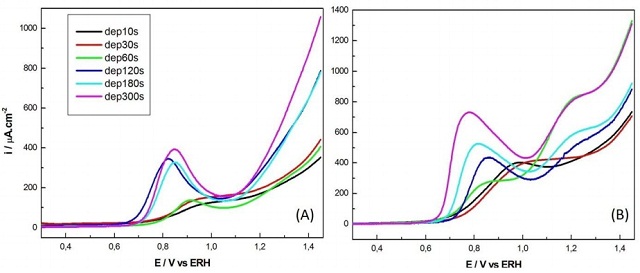
Dados potenciometricos
A partir do potencial de 0,4 V há um aumento lento na corrente, pois já existem moléculas de água adsorvidas (SOCRATES, 2001), permitindo a oxidação de intermediários resultando em um máximo próximo a 0,85V. É observado que aumentando a quantidade de platina depositada há uma diminuição no potencial de inicio dessa oxidação principalmente em 55ºC. Além deste potencial, há uma queda de corrente e logo volta a aumentar. Isto pode ser atribuído principalmente à oxidação do CO a CO2, percebida pela diminuição da banda de CO. Com o acréscimo da temperatura um novo pico de oxidação em 1,2V aparece. Possivelmente isto aconteça por que com esse incremento, há um aumento na taxa de produção de óxidos (CAMARGO et al., 2010) em platina, favorecendo a formação de espécies oxigenadas.
CONCLUSÕES: O aumento da temperatura favorece a diminuição dos potenciais de oxidação do glicerol, bem como ocasiona um aumento nos níveis de corrente, além de favorecer a formação de espécies oxigenadas durante a catálise em altos potenciais. Diferentes mecanismos durante a oxidação do glicerol conduzem a produtos com menor conteúdo energético. As medidas de espectroscopia puderam detectar a formação de CO2, gliceraldeído e ácido carboxílico bem como o COad. A formação de CO2 confirma que a adsorção de glicerol em uma das vias, é seguida pela quebra das ligações entre carbonos.
AGRADECIMENTOS: Ao laboratório de eletroquímica da UFMA onde este trabalho foi feito. Ao IQSC por permitir o uso do equipamento de infravermelho. Ao CNPq pela bolsa concedida.
REFERÊNCIAS BIBLIOGRÁFICA: CAMARA, G. A.; LIMA, R. B. de; IWASITA, T. The influence of PtRu atomic composition on the yields of ethanol oxidation: A study by in situ FTIR spectroscopy. Journal of Electroanalytical Chemistry. v. 585, p. 128 – 131, 2005.
CAMARGO, A. P. M.; PREVIDELLO, B. A. F.; VARELA, H.; GONZALEZ, E. R. Effect of temperature on the electro-oxidation of ethanol on platinum. Química Nova, vol. 33, p. 2143 – 2147, 2010.
GALLEZOT, P. Selective oxidation with air on metal catalysts. Catalysis Today. v. 37, p. 405 – 418, 1997.
IWASITA, T.; NART, F. C. In situ infrared spectroscopy at electrochemical interfaces. Progress in Surface Science. v. 55, p. 271 – 340, 1997.
IWASITA, T.; RASCH, B.; VIELSTICH, W. A SNIFTIRS study of ethanol oxidation on platinum. Electrochimica Acta. v. 34, p. 1073 – 1079, 1989.
JEFFERY, D. Z.; CAMARA, G. A. The formation of carbon dioxide during glycerol electrooxidation in alkaline media: First spectroscopic evidences. Electrochemistry Communications. v. 12, p. 1129 – 1132, 2010.
MARTINS, C. A.; GIZ, M. J.; CAMARA, G. A. Generation of carbon dioxide from glycerol: Evidences of massive production on polycrystalline platinum. Electrochimica Acta. v. 56, p. 4549–4553, 2011.
MATSUOKA, K.; IRIYAMA, Y.; ABE, T.; MATSUOKA, M.; OGUMI, Z. Electro-oxidation of methanol and ethylene glycol on platinum in alkaline solution: Poisoning effects and product analysis. Electrochimica Acta, v. 51, p. 1085-1090, 2005.
PASTOR, E.; RODRIGUEZ, J. L.; IWASITA, T. A spectroscopic proof of a surface equilibrium between on top and bridge bonded CO at Pt (110) in acid solution. Electrochemistry Communications. v. 4, p. 959 – 962, 2002.
SIMÕES, M.; BARANTON, S.; COUNTANCEAU, C. Electro-oxidation of glycerol at Pd based nano-catalysts for an application in alkaline fuel cells for chemicals and energy cogeneration. Applied Catalysis B: Environmental. v. 93, p. 354–362, 2010.
SOCRATES, G. Infrared and Raman characteristic group frequencies – Tables and charts. 3. ed. Baffins Lane: John Wiley & Sons Ltda, 2001.
WANGA, Z. X.; ZHUGE, J.; FANGA, H.; PRIOR, B. A. Glycerol production by microbial fermentation: A review. Biotechnology Advances. v. 19, p. 201–223, 2001.
