ÁREA: Físico-Química
TÍTULO: Ferro bipiridina como catalisador para redução do oxigênio molecular em meio ácido
AUTORES: BEZERRA, C. W. B; (UFMA) ; RÊGO, U. A; (UFMA) ; SILVA, H. A. S; (UFMA) ; SANTANA, S. A. A; (UFMA) ; MARQUES, A. L. B; (UFMA) ; MARQUES, E. P; (UFMA) ; PASCHOAL, C. W. A; (UFMA) ; ALMEIDA, R. M; (UFMA) ; COSTA, W. M; (UFMA)
RESUMO: Este trabalho consistiu na preparação e estudos dos catalisadores C1: Fe(10%)-Bipy/NTC e C2: Fe(5%)-TPTZ/Vulcan para redução do oxigênio à base de compostos de coordenação com ligantes nitrogenados, suportados em nanocarbonos e tratados termicamente. A comparação entre eles permitiu verificar a metodologia empregada e avaliar a atividade catalítica dos materiais. O efeito da temperatura na eficiência eletrocatalítica foi verificado para o C1 e os resultados mostraram que o suporte e a concentração do metal influenciam na capacidade catalítica dos materiais. A temperatura de otimização do C1 foi a 800 oC. Os catalisadores reduziram o oxigênio via um mecanismo de 4e-. O ligante TPTZ de algum modo favoreceu mais a geração de sítios catalíticos que os materiais com a Bipy.
PALAVRAS CHAVES: redução do oxigênio. eletrocatálise. célula a combustível.
INTRODUÇÃO: Células a combustível com membranas trocadoras de prótons, vem despertando o interesse por ser uma das formas alternativas de energia limpa e ser baseada em recursos renováveis primando pela conservação do meio ambiente. Os materiais baseados em compostos de coordenação, especificamente os de Fe e Co, com ligantes nitrogenados, dispersos em nanocarbono e tratados termicamente, vêm apresentando resultados promissores (BEZERRA, 2008; LI, 2010). Sendo capaz de promover a redução do oxigênio molecular por um mecanismo de 4e-, isto é, sem a formação de peróxido de hidrogênio, o que aumenta a eficiência da célula e a durabilidade do catalisador. Deste modo preparamos dois catalisadores não nobres, à base de Fe(II) com ligantes nitrogenados Bipy e TPTZ, esse segundo catalisador preparado para comparação da metodologia empregada, já relatado na literatura (BEZERRA, 2008), estes foram impregnados em nanopartículas de carbono e tratados termicamente.
MATERIAL E MÉTODOS: Os íons complexos foram sintetizados de acordo com a literatura (BERRY, 1990; MATTER, 2007), consistiu nas seguintes etapas: (i) solubilização dos ligantes (2,2’-Bipiridina e 2,4,6-Tris(2-piridil)–1,3,5–Triazina, Aldrich); (ii) solubilização do metal precursor Fe(NH4)2(SO4)2.6H2O e (iii) transferência da solução contendo o íon de metal para a solução contendo o ligante. Os íons complexos sintetizados foram [Fe(Bipy)3]2+ e [Fe(TPTZ)2]2+ com carga de metal 10 e 5%, na proporção M:L 1:3,1 e 1:2,1, respectivamente. Os espectros eletrônicos foram registrados em um Espectrofotômetro UV-visível da Varian, modelo Cary 50, em células de quartzo de caminho óptico igual a 1.0 cm. Logo após, os complexos foram impregnados sobre 1,0000 g dos suportes nanotubos de carbono-NTC (INPE) e Carbon Black Vulcan XC 72R (Cabot) e seco em estufa preparando os seguintes catalisadores C1: Fe(10%)-Bipy/NTC e C2: Fe(5%)-TPTZ/Vulcan. O efeito da temperatura na atividade eletrocatalítica foi investigado para o catalisador C1: Fe(10%)-Bipy/NTC. Este material foi tratado termicamente a temperaturas de 600, 700, 800, 900 e 1000 oC (Forno da EDG, modelo 10P-S), em atmosfera de N2, por um período de 2 h. A preparação do ink (tinta catalítica), a suspensão do catalisador foi preparada com a mistura da massa 5 mg do catalisador com água, álcool e nafion (Aldrich, 5 wt %) na proporção 1,4:1:100 µL, respectivamente. Em seguida, 20 µL deste material foram distribuídos na superfície do eletrodo de trabalho e seco. A análise da atividade catalítica foi realizada em um potenciostato modelo CV-50W da Bioanalytical Systems, empregando-se uma célula eletroquímica convencional de vidro com três compartimentos. Todas as medidas foram realizadas em H2SO4 0,5 mol.L-1 (BEZERRA,2008; LI, 2010).
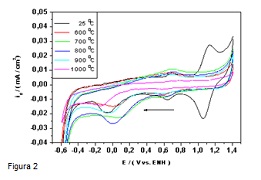
RESULTADOS E DISCUSSÃO: O Uv-vis para os íons complexos sintetizados em meio hidroalcoólico e não puramente em meio aquoso podem ser observados na Fig.1 (I) para o cátion [Fe(Bipy)3]2+ um λmax= 521 nm (1,15 x 103 L.mol-1.cm-1) e um segundo pico em 490 nm, ambos próximos ao relatado na literatura (GRIFFITHS, 1983). (II) para o cátion [Fe(TPTZ)2]2+ um λmax= 625 nm; λsh= 555 nm (1,7 x 104 L.mol-1.cm-1), observou-se uma alteração maior em relação aos dados da literatura (COLLINS, 1959; GRIFFITHS, 1983), estas diferenças podem ser justificadas em função da natureza do solvente. A avaliação da atividade eletroquímica foi realizada em dois momentos distintos, sem o tratamento térmico para o C1 foi possível constatar o processo redox que ocorre no centro metálico do complexo suportado E1/2 1,10 V, e a onda catódica para a redução do oxigênio, mostrou um comportamento eletroquímico reversível quando adsorvido ao contrário do íon complexo em solução. A Fig.2 mostra o estudo da temperatura de pirólise para o C1 indicando que a 800 oC foi obtido o melhor potencial apresentando uma melhora significativa na atividade catalítica. Quando tratado termicamente o C1 passa de EO 0,236 para 0,487 V, id -0,019 para -0,026 mA/cm2. O C2 apresenta potenciais EO antes e após o tratamento térmico com EO 0,323 V passando para 0,767 V e id -0,031 para -0,203 mA/cm2. O estudo do eletrodo de disco rotatório para os dois catalisadores antes e após o tratamento térmico apresentou boa linearidade com a reta teórica prevista para um processo de redução de mecanismo de 4e- (BEZERRA, 2008; LI, 2010).
CONCLUSÕES: O estudo dos catalisadores para a reação de redução do oxigênio molecular permite concluir que a natureza do suporte, a carga do metal e temperatura de pirólise destes materiais influenciam na capacidade de catalisarem a redução do oxigênio e que de alguma forma o C2: Fe(5%)-TPTZ/Vulcan apresentou uma atividade catalítica superior ao C1: Fe(10%)-Bipy/NTC. E ambos, catalisam a redução do oxigênio por um mecanismo via 4e-.
AGRADECIMENTOS: Os autores deste trabalho agradecem ao: CNPq (pela bolsa de mestrado), FAPEMA (pelo apoio financeiro).
REFERÊNCIAS BIBLIOGRÁFICA: BEZERRA, C. W. B.; ZHANG, L.; LEE, K.; LIU, SHI, H.; ZHANG, J.; SHI, Z.; A. L. B. MARQUES; WU, P. S. Wu, ZHANG, J. Electrochimica Acta 53 (2008) 7703-7710.
BEZERRA, C.W.B.; ZHANG, L.; LIU, H.; LEE, K.; MARQUES, A. L. B.; MARQUES, E. P.; WANG, H.; ZHANG, J. Electrochimica Acta 53 (2008) 4937-4951.
BERRY, F. J.; HAYES, M. H. B.; JONES, S. L. Inorg. Chim. Acta 178 (1990) 203-208.
MATTER, P. H.; WANG, E.; MILLET, J. M.; OZKAN, U. S. Phys. Chem. C 111(2007) 1444-1450.
LI, S.; ZHANG, L.; LIU, H.; PAN, M.; ZAN, L.; ZHANG, J. Electrochimica Acta 55 (2010) 4403-4411.
GRIFFITHS, L.; STRAUGHAN, B. J. Chem. Soc. Dalton Trans. (1983) 305 -309.
COLLINS, P. F.; DIEHL, H.; SMITH, G. F. Anal. Chem. 31 (1959) 1862–1867.
