ÁREA: Química Analítica
TÍTULO: MÉTODO ANALÍTICO MULTIRESIDUAL PARA DETERMINAÇÃO DE DESREGULADORES ENDÓCRINOS EM ÁGUA POR EFS E CLAE/FL.
AUTORES: MELO, S.M. (IFMA) ; BRITO, N.M. (IFMA)
RESUMO: Os desreguladores endócrinos (DE) refletem negativamente no ambiente, porque alteram fatores determinantes nos indivíduos afetando populações de espécies. Devido a ineficiência no tratamento de esgotos e efluentes (ETEs), estão presentes nas águas em concentrações na ordem de ng L-1, porém prejudiciais aos seres vivos. Neste contexto, fazem-se necessários métodos sensíveis e eficientes na detecção destes compostos. Neste trabalho é discutido o desenvolvimento de um método que utilizou extração em fase sólida (EFS) aliada a cromatografia líquida de alta eficiência (CLAE) acoplada ao detector fluorescência na determinação dos desreguladores endócrinos bisfenol A (BPA) e 17a-etinilestradiol(EE2)em águas da cidade de São Luís, MA.
PALAVRAS CHAVES: poluentes emergentes. estrogênios. cromatografia líquida
INTRODUÇÃO: Englobando várias classes de compostos químicos como fármacos, plastificantes, HPA’s, pesticidas e hormônios naturais, os DEs alcançam o ambiente através de efluentes industriais, esgoto doméstico, lixiviação, agricultura, etc.(SODRÉ et al, 2007; HESS, 2010).
O plástico bisfenol A e estrogênio sintético etinilestradiol já foram detectados em vários países e matrizes aquosas (AZEVEDO et al, 2001; CARGÖUET et al, 2004; ARDITSOGLOU & VOUTSA, 2008). No Brasil, foram encontrados em baixas concentrações (SODRÉ et al, 2010; TERNES et al, 1999), porém relevantes para os organismos vivos, pois segundo Silva e Collins (2011), a entrada contínua destes contaminantes no meio ambiente afeta negativamente a cadeia trófica. Técnicas mais sensíveis envolvendo preparo da amostra e quantificações dos analitos vêm sendo exigidas e aperfeiçoadas no decorrer de alguns anos (GABET et al, 2007).Para o preparo das amostras as técnicas mais comuns são extração em fase sólida (EFS) e microextração em fase sólida (MEFS), já para a detecção, a cromatografia a gás (CG) e a cromatografia líquida de alta eficiência (CLAE), acopladas a uma variedade de detectores, como eletroquímico, fluorescência (FL), espectrométrico de massas (EM) e ultravioleta com conjunto de diodos (UV-DAD) (CHANG et al, 2009; GABET et al, 2007; MANSILLHA et al, 2010; ALDA e BARCELÓ, 2000; ALDA E BARCELÓ, 2001).
No Maranhão, a precariedade do saneamento básico no estado sugere pesquisas para a determinação de DEs em suas águas, pois, segundo a Pesquisa Nacional de Saneamento Básico (PNSB) realizada pelo IBGE, até 2008 o Maranhão, foi o estado que apresentou menor percentual de tratamento de esgoto com 1,4 %. Com esse índice, ressalta-se a importância de investigar a presença de desreguladores endócrinos em águas maranhenses.
MATERIAL E MÉTODOS: Os padrões e solventes empregados são de grau cromatográfico, com 98 e 97 % de pureza para os padrões 17a-etinilestradiol (EE2) e Bisfenol A (BPA), respectivamente. Uma solução mista foi preparada em acetonitrila (ACN) da Carlo Erba Reagents com concentração igual a 100 mg L-1 (solução estoque) e a partir desta foram feitas diluições para as demais concentrações. O desempenho do método foi avaliado através da verificação da linearidade, limite de detecção (LD), limite de quantificação (LQ), precisão, exatidão e seletividade.
Para as análises cromatográficas utilizou-se equipamento cromatográfico com duas bombas de alta pressão da marca Shimadzu® (DGU- 20A), acoplado a um detector de fluorescência (RF-10AXL Shimadzu). A coluna utilizada para a separação dos compostos foi Luna C18 (octadecilsilano) com 250 x 4,6 mm e partículas de 5 m (Phenomenex®) e pré-coluna C18 com 5 cm.
A seletividade do método foi analisada pela comparação de cromatogramas (ver figura 1). Como a matriz sem BPA estava indisponível, o estudo foi realizado comparando as inclinações das curvas analíticas da amostra padrão (sem matriz) e da matriz com adição de padrão, aplicou-se o teste t para dados “pareados” para verificar a o efeito matriz.
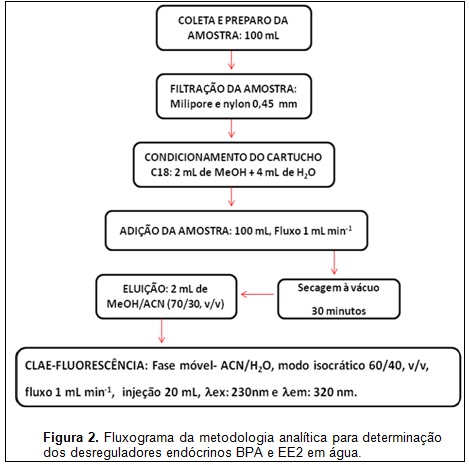
Para os estudos de extração em fase sólida foram realizados seis ensaios (E1; E2; E3; E4; E5; E6;) que variaram, no tipo de cartucho, volume de amostra e condicionamento e eluição dos cartuchos (ver tabela 1). Para as etapas de condicionamento e adição da amostra empregou-se vazão de 1 mL min-1 e na eluição somente a ação da gravidade. Empregou-se água de torneira para os ensaios de recuperação com volumes de amostra variados (100 e 200 mL). Os níveis de fortificação usados foram 0,002 e 0,005 mg L-1 cada um com quatro repetições.
RESULTADOS E DISCUSSÃO: As melhores condições cromatográficas empregaram fase móvel (ACN:H2O) 60:40 v:v, fluxo em 1 mL min-1, ex= 230nm e em= 320 nm (volume de injeção 20 L). O método foi linear entre 2,5 a 100 g L-1 para o BPA e 2,5 a 200 g L-1 para o EE2. Os limites de detecção e quantificação foram estimados nos parâmetros da curva analítica (ver tabela 1). O teste t para dados pareados analisou as curvas analíticas dos compostos na matriz e na ausência da matriz na faixa de concentração de 10 a 400 g L-1, para o nível de confiança de 95% e grau de liberdade n-1. O valor de tcalculado foi menor que o ttabelado para ambos os compostos. Comparando os valores de t pode-se afirmar que a interferência da matriz que ocorre é insignificante para o estudo, pois, segundo o INMETRO (2003), quando o valor de tcal < ttab a matriz não interfere no ensaio analítico, assim o método pode ser considerado seletivo, pois pelos cromatogramas verificamos que mesmo na presença de interferentes os analitos de interesse são identificados (ver figura 1). Os valores de recuperação foram comparados e o que obteve melhor desempenho foi o E6 com percentuais entre 70 a 87% para os dois níveis de fortificação. O E6 utilizou cartuchos C18 (500mg/6mL) condicionados com 2mL de metanol e 4mL de água deionizada, volume de amostra foi de 100 mL e a eluição foi realizada com 2 mL de uma mistura metanol/acetonitrila 70/30 v/v. Os intervalos dos coeficientes de variação entre 1,89 e 13,3 apresentados pelo método são considerados adequados, pois obedecem ao limite recomendado (20%) (RIBANI, et al 2004).Um fluxograma do método analítico foi proposto na figura 2 para visão geral do processo de coleta, preparo da amostra e análise cromatográfica.
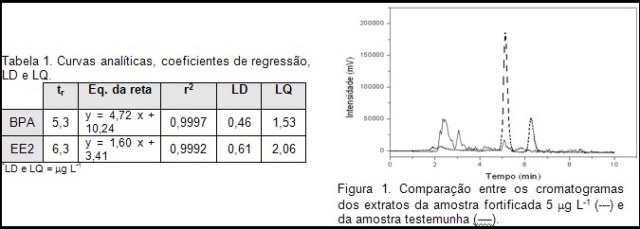
CONCLUSÕES: A metodologia analítica desenvolvida é simples e eficiente para a análise dos compostos BPA e EE2. O cartucho C18 (500mg/6mL) apresentou melhores resultados para a extração dos analitos com recuperações de 87% e 82 % para BPA e EE2, respectivamente. O método foi validado, portanto considerado, até o momento, seletivo, linear, preciso e exato para o preparo da amostra. Os LDs e LQs estimados para os analitos foram 0,46 e 1,53 g L-1 para o BPA e 0,61 e 2, 06 g L-1 para o EE2.
AGRADECIMENTOS: Agradecimentos a Capes e ao CNPq pelo apoio financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: ALDA, M J L & BARCELÓ D. J. Chromatogr. A, 892, 2000, 391.
ALDA, M J L & BARCELÓ D. J. Chromatogr. A, 938, 2001, 145.
ARDITSOGLOU, A & VOUTSA, D. Env Sci Pollut Res., 15, 2008, 3.
AZEVEDO, D. A.; LACORTEB, S.; VIANA, P.; BARCELÓ, D.; J. Braz. Chem. Soc., 12, 2001, 532.
CARGOUËT M; PERDIZ D; MOUATASSIM-SOUALI A; TAMISIER-KAROLAK S; LEVI, Y. Sci. Total Environ., 324, 2004, 55.
CHANG, H S, CHOO K H, LEE B, CHOI S J. Journal of Hazardous Materials, 172, 2009, 1.
GABET, V; MIÈGE, C; BADOS, P; COQUERY, M. Trends in Analytical Chemistry. 26, 2007, 11.
HESS, S C. Engenharia Ambiental-Espírito Santo do Pinhal, 7, 2010, 311.
IBGE - INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATISTICA. Pesquisa Nacional de Saneamento Básico (PNSB): IBGE, 2008. Disponivel em: http://www.ibge.gov.br/home/presidencia/noticias/noticia_visualiza.php?id_noticia=1691&idpagina=1Acesso em: 2 fev. 2010
INSTITUTO NACIONAL DE METROLOGIA, NORMALIZAÇÃO E QUALIDADE INDUSTRIAL (INMETRO); Orientações sobre Validação de Métodos de Ensaios Químicos, DOQ-CGCRE-008, 2003.
MANSILHA, C; MELO, A; REBELO, H; FERREIRA, I M P L V O; PINHO, O; DOMINGUES, V; PINHO, C; GAMEIRO, P. J. Chromatogr. A, 1217, 2010, 6681.
RIBANI, M; BOTTOLI, C B G; COLLINS, C H; JARDIM, I C S F; MELO, L F C. Quím. Nova, 27, 5, 2004, 771.
SILVA, C G A, COLLINS, CH. Química. Nova. 4, 2011, 665.
SODRÉ, F. F.; MONTAGNER, C. C.; LOCATELLI, M. A. F. & JARDIM, W. F. J. Braz. Soc. Ecotoxicol. 2, 2007, 2.
SODRÉ, F. F.; LOCATELLI, M. A. F. & JARDIM, W. F. J. Water Air Soil Pollut., 206, 2010, 57.
TERNES, T. A.; STUMPF, M.; MUELLER, J.; HABERES, K.; WILKEN, R.-D.; SERVO, M. Sci. Total Environ. 225, 1999, 81.
