ÁREA: Química Analítica
TÍTULO: DETERMINAÇÃO DA ATIVIDADE ANTIMICROBIANA DE QUINOLONAS CONTRA CEPAS DE Staphylococcus aureus.
AUTORES: GOMES, MARINA DE FARIA (FAMINAS) ; GOUVÊIA, MONICA IRANI DE (UNEC/FAMINAS) ; BARBIÉRI, ROBERTO SANTOS (UNEC/FAMINAS) ; VIEIRA, CARLOS ALEXANDRE (ISED/INESP) ; PÓVOA, HELVÉCIO CARDOSO CORREÁ (UFF)
RESUMO: Um dos principais agentes causadores de infecções hospitalares é o Staphylococcus aureus. Com a introdução da meticilina na terapêutica de infecções estafilocócicas, ocorreu um aumento significativo de isolados denominados MRSA (methicillin-resistant Staphylococcus aureus). Este estudo visou avaliar a atividade antibacteriana, através da medida da concentração inibitória mínima in vitro de derivados de quinolonas contra cepa de S. aureus ATCC 29213.
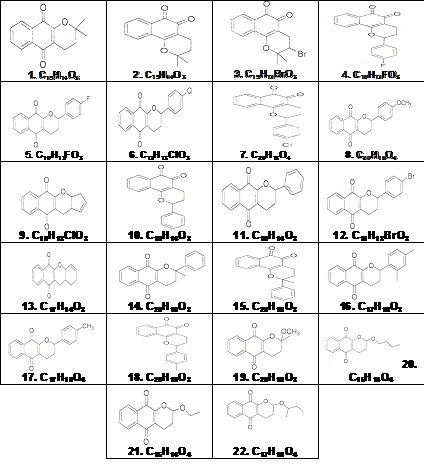
Foram estudadas vinte e duas quinolonas, identificadas de 1 a 22, sintetizados e identificados pelo grupo de pesquisa do Laboratório da UFF. Entre os compostos constatou-se que a substância 4, um flúor derivado, como a mais ativa enquanto a substância 12, um bromo derivado, foi a de mais baixa atividade.
PALAVRAS CHAVES: antimicrobianos; quinolonas; resistência.
INTRODUÇÃO: A resistência do S. aureus aos antibióticos tem sido desenvolvida por mutações em seus genes ou pela aquisição de genes de resistência de outras bactérias da mesma espécie (ou de outras). No Brasil, 40 a 60% dos S. aureus isolados de amostras provenientes de pacientes hospitalizados são resistentes à meticilina, devido ao gene cromossômico mecA, que produz uma proteína ligadora de penicilina (PBP) com baixa afinidade pelos beta-lactâmicos [1-2]. A resistência fenotípica à oxacilina é extremamente variável e depende da expressão do gene mecA. Essa variabilidade é reconhecida como heterorresistência fenotípica, e se caracteriza pelo fato de que de toda população bacteriana heterogeneamente resistente, assim como todas as células, carregam o gene mecA, marcador genotípico da resistência, porém nem todas expressam fenotipicamente sua resistência da mesma forma [3].
As fluoroquinolonas compreendem uma série de amplo espectro de agentes antibacterianos sintéticos, derivados do ácido nalidíxico [4], que agem por inibição da enzima alvo, DNA girase, uma topossomerase tipo II, responsável primariamente pela introdução da superhelicoidização negativa do DNA na presença de ATP, que desempenham funções nos processos de replicação, transcrição, recombinação e reparação celular [5].
Vários estudos descreveram modificações no anel quinolona, por exemplo: substituição com diferentes grupos em anéis aromáticos, a substituição do mesmo anel tiofeno por metade, a introdução do grupo amido na C-3, bem como a substituição de N-1 por moléculas de açúcar ou acíclicos [6].
Este estudo visa avaliar a atividade antibacteriana, a toxicicidade e irritabilidade in vitro de derivados de quinolonas contra cepa de S. aureus ATCC 29213.
MATERIAL E MÉTODOS: Foram estudadas as vinte e duas quinolonas apresentadas na Figura. Todos os compostos foram previamente sintetizados e identificados pelo grupo de pesquisa do Laboratório da UFF.
A susceptibilidade opor concentração mínima inibitória está padronizada e fornece resultados quantitativos [7]. A avaliação da atividade antimicrobiana dos compostos da foi feita aplicando método de difusão em meio sólido (processo cavidade-placa). Em placas de Petri contendo 20 mL do meio Agar Müeller-Hinton, a bactéria foi inoculada por espalhamento com auxílio de swabs estéreis mergulhados na suspensão contendo o inóculo bacteriano, obedecendo 5 x 106 UFC/mL (0,5 da escala de MacFarland). Após 5 minutos, realizou-se perfurações nas placas de modo a obter-se orifícios de 6 mm de diâmetro, onde foram adicionados 50 µL da solução teste em diferentes concentrações para verificação da CIM através do decréscimo do tamanho dos halos de inibição de crescimento. O controle foram 50 µL (microlitros) do solvente DMSO (dimetilsulfóxido) em um dos orifícios. Incubaram-se as placas em estufa a 35ºC por 24 horas. Os resultados considerados foram aqueles com halos de inibição igual ou superior a 8 mm de diâmetro [8]. Catão et al. 2009.
RESULTADOS E DISCUSSÃO: O padrão de substituição selecionado neste trabalho envolveu a introdução estratégica de grupos substituintes no anel benzênico, baseando-se em faixa de hidrofobicidade ótima. Considerou-se ainda, variações de efeito eletrônico dos grupos selecionados.
Entre os compostos avaliados frente à cepa Staphylococcus aureus, constatou-se que a substância 4, uma quinolona flúor substituida, se mostrou como o derivado mais ativo enquanto que a substância 12, uma quinolona bromo substituída, se apresentou como o composto de mais baixa atividade.
As substâncias 2, 3, 7, 13, 15 e 20 apresentaram semelhantes halos de inibição de crescimento na concentração inicial, enquanto que nessa mesma concentração, as substâncias 11, 12 e 16 apresentaram halos de inibição de crescimento de 13 mm, 12 mm e 13 mm de diâmetro respectivamente. O decréscimo dos halos de inibição das substâncias 1, 2, 11, 12 e 16 demonstram que, na diluição estudada, essas substâncias começam a perder o efeito bactericida.
CONCLUSÕES: O desenvolvimento de mecanismos de resistência aos antibióticos demonstrado pelo S. aureus está diretamente relacionado com os procedimentos empregados na sua antibioticoterapia. Os extensivos estudos de relações entre a estrutura e a atividade antibacteriana objetivam projetar a síntese de novos compostos com melhor espectro de ação, otimizando também a farmacocinética e reduzindo a toxicidade e interações medicamentosas. Essas pesquisas permitiram uma melhor definição de grupamentos importantes que poderiam oferecer a melhor combinação entre eficácia clínica, seletividade e segurança.
AGRADECIMENTOS: À Faculdade de Minas de Muriaé (FAMINAS), ao Centro Universitário de Caratinga (UNEC) e ao Instituto Superior de Educação de Divinópolis (ISED), pelo apoio.
REFERÊNCIAS BIBLIOGRÁFICA: [1] SOUSA JUNIOR, Francisco Canindé de et al . Prevalência de Staphylococcus spp resistentes à meticilina isolados em uma maternidade escola da Cidade de Natal, Estado do Rio Grande do Norte. Revista da Sociedade Brasileira de Medicina Tropical, Uberaba, v. 42, n. 2, Apr. 2009.
[2] GAYOSO, Maria de Fátima Azevedo et al. Suscetibilidade antimicrobiana in vitro dos Staphylococcus coagulase negativa oculares. Arquivo Brasileiro de Oftalmologia, São Paulo, v. 70, n. 6, dez. 2007.
[3] MIMICA, Marcelo J.; MENDES, Caio M. F.. Diagnóstico laboratorial da resistência à oxacilina em Staphylococcus aureus. Jornal Brasileiro de Patologia e Medicina Laboratorial, Rio de Janeiro, v. 43, n. 6, dez. 2007.
[4] KASSAB, Nájla Mohamad et al . Quantitative determination of ciprofloxacin and norfloxacin in pharmaceutical preparations by high performance liquid chromatography. Revista Brasileira de Ciências Farmacêuticas, São Paulo, v. 41, n. 4, dez. 2005.
[5]. PEREIRA, Maria S.V.; SIQUEIRA JUNIOR, José P.; TAKAKI, Galba M. Campos. Eliminação de resistência a drogas por fluorquinolonas em Staphylococcus aureus de origem bovina. Pesquisa Veterinária Brasileira, Rio de Janeiro, v. 24, n. 1, mar. 2004.
[6]. AL-SOUD, Yaseen A.; AL-MASOUDI, Najim A.. A new class of dihaloquinolones bearing N'-aldehydoglycosylhydrazides, mercapto-1,2,4-triazole, oxadiazoline and a-amino ester precursors: synthesis and antimicrobial activity. Journal Brazilien of Chemistry Society, São Paulo, v. 14, n. 5, out. 2003.
[7]. BRITO, M.A.V.P. et al . Concentração mínima inibitória de dez antimicrobianos para amostras de Staphylococcus aureus isoladas de infecção intramamária bovina. Arquivo Brasileiro de Medicina Veterinária Zootecnia, Belo Horizonte, v. 53, n. 5, out. 2001.
