ÁREA: Ambiental
TÍTULO: CARACTERIZAÇÃO DE UMA PEROXIDASE COMERCIAL E SUA APLICAÇÃO DA REMOÇÃO DO BIOCIDA TRICLOSAN EM MEIO AQUOSO
AUTORES: C. F. MELO (UNILESTE-MG) ; M. T. A. QUEIROZ (UNILESTE-MG) ; M. DEZOTTI (PEQ/COPPE/UF)
RESUMO: A presença de triclosan no ambiente aquático pode contribuir para o surgimento de
microrganismos resistentes a antibióticos. Os objetivos desse foram caracterizar uma
peroxidase comercial (HRP da Sigma Aldrich) e avaliar a influência do pH e da
temperatura na conversão do triclosan catalisada por essa enzima. A massa molecular da
enzima foi estimada em 36,5 kDa. A enzima apresentou baixo grau de pureza e além enzima
foram detectadas outras proteínas presentes no preparado comercial. Na faixa de pH de
3-9, a 25ºC, a maior remoção de triclosan foi obtida em pH 7. Em pH 7, a conversão
aumentou de 21% a 10ºC para 38% a 40ºC. A enzima removeu eficientemente o biocida
triclosan em meio aquoso, o que indica que pode ser aplicada em matrizes ambientais
contaminadas com o biocida.
PALAVRAS CHAVES: remoção seletiva, micropoluentes, peroxidase de raiz-forte
INTRODUÇÃO: Triclosan é um bactericida amplamente empregado em produtos de higiene pessoal como
sabonetes anti-sépticos, enxaguatórios bucais, desodorantes, e em vários produtos
cosméticos (NICNAS, 2009). O lançamento de resíduos de triclosan em águas de
superfície deve ser evitado por muitas razões, que incluem o aparecimento de
resistência a antibióticos entre os microrganismos expostos (Schweizer, 2001) e a
formação do composto carcinogênico 2,8-diclorodibenzo-p-dioxina durante sua fotólise
(Lores et al., 2005; Mezcua et al., 2004). Assim, o desenvolvimento de processos de
tratamento que aumentem o nível de remoção de triclosan é necessário para a completa
eliminação da atividade biológica desses efluentes. Nesse sentido, processos
avançados como ozonização (Suarez et al., 2007), irradiação UV (Aranami e Readman,
2007), fotocatálise (Son et al., 2009), e adsorção em carvão ativado (Behera et al.,
2010) têm sido avaliados para a remoção de triclosan. No entanto, esses processos
possuem baixa seletividade na remoção de triclosan em matrizes complexas, como esgoto
doméstico, que possui diversos compostos orgânicos em concentrações muito maiores
(Auriol et al., 2007). Por outro lado, os processos enzimáticos são promissores em
função de vantagens inerentes como remoção seletiva de poluentes específicos, altas
taxas de reação e operação em amplas faixas de pH (Ikehata et al., 2004). Esse
trabalho teve como objetivos: caracterizar uma peroxidase comercial (HRP da Sigma
Aldrich) e avaliar o efeito do pH e da temperatura na conversão de triclosan
catalisada pela enzima HRP em água ultrapura e determinar.
MATERIAL E MÉTODOS: A pureza da enzima comercial HRP adquirida da Sigma-Aldrich foi avaliada pela técnica
SDS-PAGE (Eletroforese em gel de poliacrilamida contendo dodecilsulfato de sódio)
utilizando gel de corrida a 10% e gel de nivelamento a 4%. Após a corrida
eletroforética, os géis foram corados com azul brilhante de Coomassie. Juntamente com
as amostras, foi aplicada no gel uma mistura de padrões de massas moleculares da BIO-
RAD com as seguintes massas: 250, 150, 100, 75, 50, 37 e 25 kDa.O teor de proteínas
foi determinado pelo método de Bradford (1976).
A atividade da solução-estoque de HRP foi determinada frequentemente antes dos
experimentos por meio de um ensaio colorimétrico baseado no uso de fenol como
substrato redutor e 4-aminoantipirina (AAP) como substrato cromogênico e outro ensaio
com ABTS (Nicell e Wright, 1997).
Foram avaliadas as influências dos parâmetros pH e temperatura na conversão de
triclosan catalisada por HRP. Nesses experimentos, as reações enzimáticas foram
realizadas em vials âmbar de 4 mL, utilizando um volume reacional de 1 mL.
Inicialmente, foi adicionado um volume da solução-estoque da enzima inferior a 5% do
volume reacional nos vials de uma determinada batelada de experimentos. A reação foi
iniciada pela adição de uma solução de triclosan de 20 µM com H2O2 em tampão citrato-
fosfato com pH na faixa de 3 a 10, ao vial contendo a enzima. Em seguida, os vials
foram mantidos em uma incubadora com agitação orbital com temperatura numa faixa de
10 a 40 ºC e agitação de 200 rpm. Após o período de incubação, a reação nos vials foi
interrompida pela adição de um volume de H3PO4 3M suficiente para reduzir o pH a 2,0.
Para a determinação da concentração, foi utilizado um HPLC Shimadzu modelo LC-20A,
equipado com uma coluna C18 da Shimadzu modelo Shim-Pack VP-ODS.
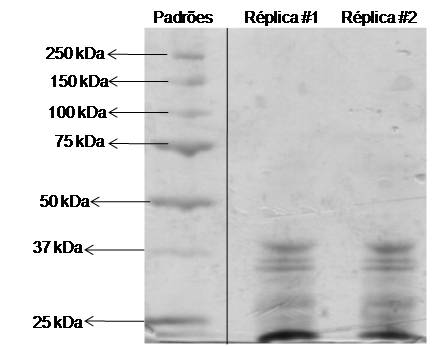
RESULTADOS E DISCUSSÃO: Conforme mostrado na Figura 1, a SDS-PAGE da HRP da Sigma-Aldrich, exibiu três
bandas bem definidas com massas similares ao do padrão de 37 kDa e uma banda bem
intensa de proteínas com massas inferiores a 25 kDa, conforme mostrado na Figura 1.
Além disso, o teor de proteínas foi de 28% (m/m), indicando que o grau de pureza é
baixo e que, além da HRP, outras proteínas estão presentes.
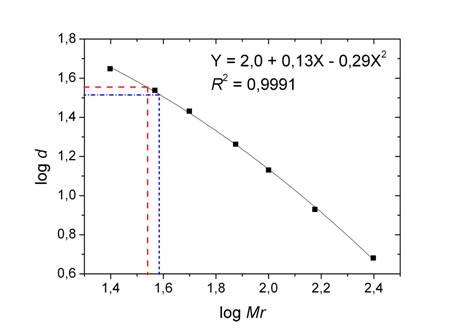
Utilizando a correlação entre as massas moleculares dos padrões e as respectivas
distâncias percorridas na corrida eletroforética (Figura 2), foram estimadas as
massas moleculares das três bandas definidas da HRP. A faixa de massas moleculares
foi de 34 a 39 kDa, um pouco menor do que a determinada por Regalado et al. (1996),
que foi de 44 kDa, que utilizaram a mesma técnica.
A conversão de triclosan catalisada por HRP ocorreu na faixa de pH de 3 a 9. Dentro
dessa faixa de pH, a conversão máxima foi observada em pH 7. Essa faixa de pH foi bem
mais ampla do que para a lacase, que conforme observado por Kim e Nicell (2006) foi
de 4 a 7, e o pH em que a conversão é máxima muito mais próximo do pH de efluentes
de ETE (Auriol et al., 2007), considerando uma possível aplicação a esse tipo de
efluentes.
No estudo do efeito da temperatura na conversão de triclosan, verificou-se que a
conversão aumentou de 21% a 10 ºC para 37% a 40 ºC. Os ajustes dos dados a um modelo
linear ou quadrático apresentaram uma correlação muito baixa. Verificou-se assim que
a HRP é muito menos sensível a alterações na temperatura do que a lacase (Kim e
Nicell, 2006) e considerando a possibilidade de variações sazonais na temperatura de
efluentes de ETE, o tratamento com HRP parece mais apropriado.
CONCLUSÕES: A enzima oxidativa HRP foi capaz de catalisar a conversão de triclosan em uma ampla
faixa de pH e temperatura. Esse resultado mostra que o tratamento com HRP é uma
alternativa para a remoção seletiva de triclosan em matrizes ambientais complexas como
efluentes de ETE. O pH e a temperatura influenciaram significativamente a eficiência do
processo, o que indica que esses parâmetros devam ser otimizados.
AGRADECIMENTOS: Faperj, CNPq, CAPES
REFERÊNCIAS BIBLIOGRÁFICA: ARANAMI, K.;READMAN, J.W. Photolytic degradation of triclosan in freshwater and seawater. Chemosphere, v. 66 (6), p. 1052-1056, 2007.
AURIOL, M.; FILALI-MEKNASSI, Y.; TYAGI, R.D.; ADAMS, C.D. Laccase-catalyzed conversion of natural and synthetic hormones from a municipal wastewater. Water Res., v. 41 (15), p. 3281-3288, 2007.
BEHERA, S. K.; OH, S.Y.; PARK, H.S. Sorption of triclosan onto activated carbon, kaolinite and montmorillonite: Effects of pH, ionic strength, and humic acid. Journal of Hazardous Materials. No prelo 2010.
BESTER, K. Triclosan in a sewage treatment process--balances and monitoring data. Water Research, v. 37 (16), p. 3891-3896, 2003.
BRADFORD, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, v. 72 (1-2), p. 248-254, 1976.
IKEHATA, K.; BUCHANAN, I.D.; SMITH, D.W. Recent developments in the production of extracellular fungal peroxidases and laccases for waste treatment. Journal of Environmental Engineering and Science, v. 3 p. 1-19, 2004.
KANTIANI, L.; FARROM.; ASPERGER, D.; RUBIO, F.; GONZLEZ, S.; LPEZ DE ALDA, M.J.; PETROVIC, M.; SHELVER, W.L.; BARCELOD. Triclosan and methyl-triclosan monitoring study in the northeast of Spain using a magnetic particle enzyme immunoassay and confirmatory analysis by gas chromatography-mass spectrometry. Journal of Hydrology, v. 361 (1-2), p. 1-9, 2008.
KIM, Y. J.;NICELL, J.A. Laccase-catalysed oxidation of aqueous triclosan. Journal of Chemical Technology and Biotechnology, v. 81 (8), p. 1344-1352, 2006.
KOLPIN, D.W.; FURLONG, E.T.; MEYER, M.T.; THURMAN, E.M.; ZAUGG, S.D.; BARBER, L.B.; BUXTON, H.T. Pharmaceuticals, Hormones, and Other Organic Wastewater Contaminants in U.S. Streams, 1999-2000: A National Reconnaissance. Environmental Science and Technology, v. 36 (6), p. 1202-1211, 2002.
LORES, M.; LLOMPART, M.; SANCHEZ-PRADO, L.; GARCIA-JARES, C.; CELA, R. Confirmation of the formation of dichlorodibenzo-p-dioxin in the photodegradation of triclosan by photo-SPME. Analytical and Bioanalytical Chemistry, v. 381 (6), p. 1294-1298, 2005.
MEZCUA, M.; GOMEZ, M.J.; FERRER, I.; AGUERA, A.; HERNANDO, M.D.; FERNNDEZ-ALBA, A.R. Evidence of 2,7/2,8-dibenzodichloro-p-dioxin as a photodegradation product of triclosan in water and wastewater samples. Analytica Chimica Acta, v. 524 (1-2), p. 241-247, 2004.
National Industrial Chemicals Notification and Assessment Scheme (NICNAS), 2009. Australian Government, Department of Health and Ageing. Priority Existing Chemical Assessment Report No. 30, Triclosan, January (May 21th, 2009).
NICELL, J. A.;WRIGHT, H. A model of peroxidase activity with inhibition by hydrogen peroxide. Enzyme and Microbial Technology, v. 21 (4), p. 302-310, 1997.
REGALADO, C.; ASENJO, J.A.; PYLE, D.L. Studies on the purification of peroxidase from horseradish roots using reverse micelles. Enzyme and Microbial Technology, v. 18 (5), p. 332-339, 1996.
SCHWEIZER, H. P. Triclosan: a widely used biocide and its link to antibiotics. FEMS Microbiology Letters, v. 202 (1), p. 1-7, 2001.
SON, H. S.; KO, G.; ZOH, K.D. Kinetics and mechanism of photolysis and TiO2 photocatalysis of triclosan. Journal of Hazardous Materials, v. 166 (2-3), p. 954-960, 2009.
SUAREZ, S.; DODD, M.C.; OMIL, F.; VON GUNTEN, U. Kinetics of triclosan oxidation by aqueous ozone and consequent loss of antibacterial activity: Relevance to municipal wastewater ozonation. Water Research, v. 41 (12), p. 2481-2490, 2007.
TORRES, E.; BUSTOS-JAIMES, I.; LE BORGNE, S. Potential use of oxidative enzymes for the detoxification of organic pollutants. Applied Catalysis B: Environmental, v. 46 (1), p. 1-15, 2003.
YING, G. G.;KOOKANA, R.S. Triclosan in wastewaters and biosolids from Australian wastewater treatment plants. Environment International, v. 33 (2), p. 199-205, 2007.
