ÁREA: Ensino de Química
TÍTULO: A síntese de um óxido de alumínio e sua caracterização por espectroscopia na região do infravermelho: proposta de aula experimental
AUTORES: SOUZA M. F. (UFPA) ; CRUZ N. G. (UFPA) ; MONTEIRO W. R. (UFPA)
RESUMO: A experimentação representa ferramenta fundamental no ensino de química, de forma que há uma tendência em problematizar a experimentação na formação docente e assim repensar a metodológia das aulas experimentais no ensino de Química.Com a utilização das novas tendências educacionais é possível auxiliar nos mecanismos do aprendizado aplicando práticas pedagógicas eficazes tornando o aluno o construtor do próprio conhecimento.Desta forma, este trabalho busca contextualizar a problemática proposta pela prática experimental, quando localiza a origem e a função do material a ser sintetizado, além de fazer uso de técnicas para identificar o produto obtido segundo diferentes procedimentos de obtenção, atribuindo assim uma função ao material obtido seguindo uma aprendizagem significativa.
PALAVRAS CHAVES: alumina, infra-vermelho, aula experimental
INTRODUÇÃO: A bauxita é o terceiro minério mais presente na crosta terrestre ela é o minério de alumínio mais importante pois contém grande porcentagem de alumina. As maiores reservas de bauxita estão localizadas na região amazônica, principalmente no Pará, além de outras regiões.É possível obter o óxido de alumínio puro através da dissolução do minério (bauxita) em solução de hidróxido de sódio. Existem ainda outras formas de hidróxido de alumina que podem ser obtidos através de sua desidratação. Assim variando sua temperatura podemos obter a chi, gama, eta, kapa, delta e teta alumina que são ditas de transição, porém a alfa-alumina pode ser obtida também através da desidratação completa dos óxidos de alumínio a alta temperatura (950 a 1200ºC). A alumina apresenta propriedades de grande interesse para o campo industrial, graças as suas propriedades físico-quimicas que a tornam útil para várias aplicações, algumas dessas propriedades são a sua boa estabilidade térmica, resistência à corrosão tanto em ambientes ácidos como alcalinos, não sofre oxidação, ótima propriedade dielétrica (pode ser usada como isolante elétrico), ótima resistência ao desgaste, elevada área superficial interna nas formas micro e nano porosa e excelente bio-compatibilidade (empregada para aplicações biomédicas, pois também não apresentam rejeição com os tecidos vivos).Neste trabalho, será apresentada a obtenção experimental de uma alumina de transição envolvendo reagentes comerciais e equipamentos simples de laboratório. A síntese, por empregar materiais relativamente fáceis de ser obtidos, poderá ser empregada como procedimento experimental em uma aula de laboratório. Uma outra abordagem pode ser feita quanto a etapa de caracterização, a qual envolve técnica espectroscópica na região do infravermelho.
MATERIAL E MÉTODOS: Utilizou-se uma solução de aluminato de sódio, preparada com 81g de aluminato de sódio em 200mL de água destilada, a solução ficou por um período de 30 minutos sob agitação em agitador magnético (QUIMIS/ mod: Q261), obtendo-se uma solução com a presença de algumas impurezas, com isso fez-se necessário a realização de filtração.
Após a retirada das impurezas, o pH da solução foi medido, com ajuda do papel de pH, resultando em uma solução fortemente básica (pH = 14).
Submeteu-se a solução a um banho termostatizado (FISATON/ mod: 550) onde a temperatura deve estar próximo a 75ºC. Com a temperatura já ajustada a 75ºC, adicionou-se 320mL de ácido nítrico em intervalos de 15mL/min, medindo o pH da solução após cada adição, a solução permaneceu básica, mas com a formação de um precipitado branco. Essa solução permaneceu em banho por volta de 4h, sob agitação constante.
Após as 4h, fez-se a separação do precipitado branco através do processo de filtração a vácuo e posteriormente foi efetuada duas lavagens da torta com hidróxido de amônio (NH4OH) e duas lavagens com água destilada, após os processos de filtração e lavagem, separou-se duas amostras do sólido e foram levadas para o processo de secagem com tratamento térmico diferente para cada uma. A primeira amostra foi seca em estufa (QUIMIS/ mod: Q317M) a aproximadamente 100ºC e a outra amostra foi seca em um forno tubular (QUIMIS/ mod: Q320M) com temperatura aproximada de 300ºC e após tratamento térmico as amostras foram pulverizadas e levadas para análise por espectroscopia na região do infravermelho (THERMO SCIENTIFIC/ mod: Nicolet Continuµm Infrared Microscope) para comparação.Observando que para todos os procedimentos, devem ser realizasadas etapas de pesagem para avaliar o processo quanto ao rendimento.
RESULTADOS E DISCUSSÃO: A partir dos resultados de pesagens é possível abordar os quesitos quanto ao cálculo do rendimento do processo, e ainda compara com os dados da literatura, quando fornecidos pelo professor. Quanto ao procedimento de síntese é também possível questionar o aluno quanto às necessidades de se trabalhar em temperatura moderada em solução aquosa e ainda o motivo da agitação, podendo explorar os conceitos de solubilidade, e fenômenos de nucleação e crescimento de cristais em solução aquosa.
A etapa de lavagem do precipitado também pode ser abordada empregando os conceitos de equilíbrio químico em função do pH da solução empregada na etapa de lavagem.
A etapa de tratamento térmico pode ser empregada para a abordagem dos fenômenos de desidratação que acometem os materiais, sobretudo os polimerizados inorgânicos em solução aquosa.Finalmente, a aplicação de técnica de caracterização envolvendo a espectroscopia, remete aos fenômenos vibracionais que acometem espécies químicas presentes nos compostos, tais conceitos podem ser facilmente abordados pela simples comparação dos resultados e mais uma vez a interdisciplinaridade é explorada quando os conceitos de física e química aliados à matemática se combinam para se concluir que temos materiais com características químicas e/ou funções diferentes.
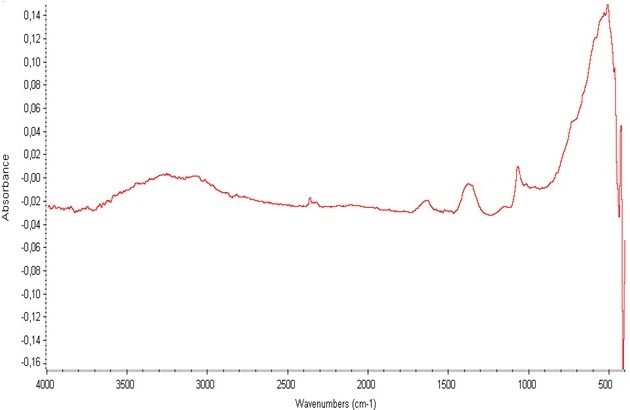
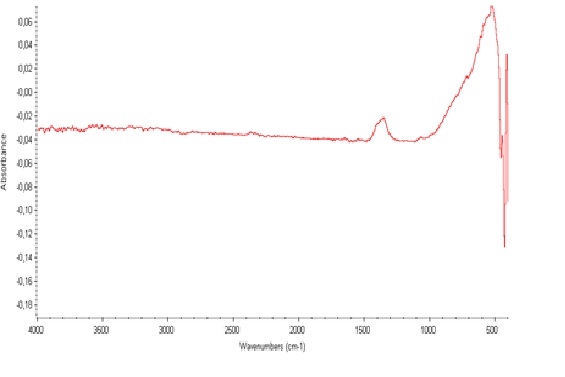
A amostra tratada a 100ºC, observar-se no espectro a região entre 2900 e 3500 cm-1 uma banda de absorção referente à presença de OH da constituição do material, principalmente pela presença de bandas de absorção na faixa de 1620cm-1, as quais podem ser comparadas com a literatura. A amostra que fora tratada a 300°C não apresentou as bandas características da presença de hidroxilas, confirmando o processo de desidroxilação ocasionado pelo tratamento térmico aplicado.
CONCLUSÕES: Segundo as novas tendências educacionais, o experimento aqui apresentado se mostra como alternativa viável para a aplicação de aula experimental voltada à química analítica, inorgânica ou físico-química, pois apresenta as etapas de síntese do material, além de contextualizar a origem e aplicação do mesmo, e ainda utiliza técnica de caracterização que envolve avaliação espectroscópica, aplicando assim a interdisciplinaridade da prática pedagógica, o que proporciona ao aluno a noção de início meio e fim, após a caracterização é fornecido ao material uma aplicação real(aprendizagem significativa)
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: HANUSKOVÁ M., Matérias primas para uso cerâmico (Coríndon – Alumina). Departamento de Engenharia dos materiais e meio ambiente. Universidade de Modena e Reggio Emilia – Modena – Italia. Publicado no mês de maio/junho nº64; pág: 24.
FREITAS, M. C. F.; MOHALLEM D. S. T.; MOHALLEN D. S. N.; Estudo e otimização de processos laboratoriais de síntese de alumina nanoparticulada e aplicação em escala industrial. Laboratório de materiais nanoestruturados, Departamento de química – ICEx/UFMG, S/D.
RAMOS, MARISE NOGUEIRA. A contextualização no currículo de ensino médio: a necessidade da crítica na construção do saber científico. Revista do Ensino Médio, Brasília, n. 3, p.8. 2004.
VASCONCELOS, CELSO DOS SANTOS. Construção do conhecimento em sala de aula. São Paulo: Libertad, 2008.
J. TANAKA, Experimental Methods in Inorganic Chemistry, Pg. 44. 1999.
Site da Associação Brasileira do Alumínio. Disponível em: http://www.abal.org.br/index.asp. Acessado em 15 de junho de 2011.
Site de pesquisa. Disponível em: http://www.infopedia.pt/$alumina. Acessado em 20 de junho de 2011.
